Результаты приведены в таблице в строке № 2.
3) В случае изотермического процесса f ( p,V ) = pV =const (следует из термического уравнения состояния). Изменения внутренней энергии не происходит, так как температура газа остается постоянной ( DU = 0). Согласно первому началу термодинамики, работа, а, следовательно, и подведенная теплота равны ( A = Q). Выражая давление через объем посредством термического уравнения состояния ( p = RT/V), в результате получаем:
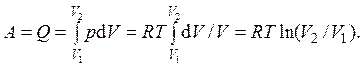
Соответственно, при постоянной температуре изменение энтропии будет равно
DS = Q/T = Rln(V2/V1).
Из определения теплоемкости следует, что в изотермическом процессе ее величина будет бесконечно большой: ненулевое подведенное тепло при нулевом изменении температуры. Результаты для изотермического процесса приведены в строке № 3 таблицы.
4) Адиабатический процесс – это равновесный процесс без подвода теплоты: dQ = 0. Изменения энтропии в соответствии со вторым началом термодинамики не будет:
![]() .
.
Теплоемкость C = 0. Изменение внутренней энергии в этом процессе, как и в других процессах, равно DU = CVDT (не зависит от процесса). По первому началу, совершаемая работа
A = – DU = – CVDT.
Остается найти уравнение процесса. Его можно получить из первого начала термодинамики в дифференциальной форме. После подстановки в него dQ = 0, dU = CV dT и dA = pdV имеем дифференциальное уравнение
CV dT + pdV = 0.
Исключение температуры с помощью термического уравнения состояния дает
dT = d( PV ) = PdV + VdP,
CV /R×Vdp + (CV /R + 1)pdV = 0, или Vdp + g pdV = 0,
где g = Cp/CV – показатель адиабаты. Уравнение решается разделением переменных. Это дает уравнение адиабатического процесса
pV g = const.
Результаты для адиабатического процесса представлены в строке № 4 таблицы.
5) Политропическим называется процесс с постоянной теплоемкостью. Она считается известной. Тогда
Q = CDT.
Изменение энтропии находится аналогично случаю изохорического и изобарического процессов с единственным изменением в теплоемкости процесса:
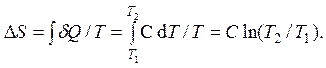
По-прежнему, DU = CVDT. В таком случае работа
A = Q –DU = (C – CV)DT.
Уравнение процесса находится, как и для предыдущего процесса.
C dT = CV dT + pdV.
Аналогично исключается температура:
dT = d( PV ) = PdV + VdP,
CV /R×Vdp + (CV /R + 1)pdV = С(PdV + VdP).
Вводится обозначение n = (C – Cp)/( C – CV) – показатель политропы. Как и в случае адиабатического процесса, здесь производится группировка слагаемых при приращении одинаковой переменной, после чего уравнение решается разделением переменных. После интегрирования находится уравнение политропического процесса
pVn = const.
Результаты для этого процесса заполняют строку № 5 таблицы.
|
№ |
f |
A |
Q |
DU |
DS |
C |
|
1 |
V |
0 |
CVDT |
CV DT |
CV ln(T2/T1) |
CV |
|
2 |
p |
RDT |
CpDT |
CV DT |
Cp ln(T2/T1) |
Cp |
|
3 |
pV |
RTln(V2/V1) |
RTln(V2/V1) |
0 |
Rln(V2/V1) |
±¥ |
|
4 |
pVg |
– CV DT |
0 |
CV DT |
0 |
0 |
|
5 |
pVn |
(C – CV)DT |
CDT |
CV DT |
C ln(T2/T1) |
C |
 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.