и с учетом того, что Q2 = – ÷Q2÷ и Q2' = – ÷Q2'÷, получается
Q1 / T1 – (÷Q2÷ + ÷Q2'÷) / T2 + Q3 / T3 ≤ 0,
или
Q1 / T1 – Q / T2 + Q3 / T3 ≤ 0.
Исключение Q3 дает
Q1 / T1 – Q / T2 + (Q – Q1) / T3 ≤ 0,
откуда
Q ≤ (T3–1 – T1–1) / (T3–1 – T2–1) × Q1.
В идеальном случае, когда какие-либо потери теплоты или работы отсутствуют и все процессы квазистатические, имеет место равенство
Q = (T3–1 – T1–1) / (T3–1 – T2–1) × Q1.
Так как T1 > T2, то T3–1 – T1–1 > T3–1 – T2–1 и полученная формула дает Q > Q1. Более того, разница температур T2 и T3 сравнительно небольшая (до нескольких десятков градусов), тогда как T1 значительно больше T2 (на сотни градусов). Поэтому множитель перед Q1 может быть порядка 10. Это говорит об эффективности динамического способа отопления.
Для условий задачи Q/Q1 = (T1 – T3)T2/(T2 – T3)/T1 ≈ 7,1.
1.10. Процесс Гей-Люссака – это расширение газа в пустоту.
Пусть сосуд с жесткими адиабатическими стенками разделен перегородкой на объемы V1 и V2. В первом объеме ν молей идеального газа при температуре T, в другом объеме – вакуум. Перегородка убирается – газ приходит в движение и заполняет весь объем сосуда V1 + V2. Это процесс Гей-Люссака.
Конечное состояние газа при его расширении равновесное. Подвода теплоты нет: Q = 0. Работа внешних сил отсутствует: A' = 0 (стенки сосуда жесткие). Внутренняя энергия газа в результате не изменится: ΔU = 0. А так как газ идеальный, то в соответствии с законом Джоуля конечная температура равна начальной температуре. Сразу же следует сделать уточнение. В процессе расширения говорить о температуре газа как целого не имеет смысла. Это неравновесный процесс, что подтверждается тем, что его конечным результатом является увеличение энтропии газа, несмотря на отсутствие подвода теплоты. Процесс протекает с конечными скоростями. Внутренняя энергия газа в процессе не остается постоянной. Она переходит в кинетическую энергию поступательного движения газа. Происходит это неравномерно. Уже с самого начала одни слои газа приходят в движение, другие еще неподвижны. Все же в конце концов кинетическая энергия движущегося газа диссипирует и переходит во внутреннюю энергию, устанавливается равновесие. Поскольку процесс неравновесный, то пользоваться непосредственно уравнением dS = δQ / T нельзя: оно справедливо только для равновесных процессов. Однако энтропия – функция состояния, ее изменение не зависит от процесса. Путей решения задачи два: можно воспользоваться известным выражением для энтропии идеального газа и по начальному и конечному состояниям вычислить ее изменение. А можно реальный (неравновесный) процесс, соединяющий два равновесных состояния, заменить подходящим равновесным, соединяющим те же два равновесных состояния (в данном случае самым простым из подходящих процессов является изотермический) и искать изменения энтропии согласно формуле dS = δQ / T в построенном равновесном процессе . Здесь рассматривается второй путь.
Вводится изотермический процесс перехода из начального состояния с объемом V1 в конечное состояние с объемом V1 + V2. В этом процессе в отличие от реального процесса есть подвод теплоты от термостата с температурой T. Эта теплота расходуется на работу газа – изотермическое расширение. В результате
ΔS = ![]() =
= ![]() =
= 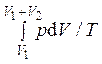 =
= 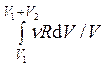 = νR·ln (1 + V2 /
V1) > 0.
= νR·ln (1 + V2 /
V1) > 0.
Возрастание энтропии указывает, что расширение в пустоту действительно неравновесный процесс.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.