Вода имеет очень малую сжимаемость. Поэтому изменением объема воды можно пренебречь. Поскольку энтропия – функция состояния, ее изменение не зависит от процесса. Для вычисления изменения энтропии воды реальный процесс выравнивания температуры заменяется изохорическим процессом. Тогда
S2 – S1 = ![]() =
= 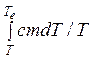 = cm×ln (Te / T),
= cm×ln (Te / T),
где m – масса воды, c – ее удельная теплоемкость.
От термостата к воде подводится количество теплоты
Q = cm(Te – T).
|
|
После подстановки выражений для S2 – S1 и Q (Te = const) приведенное выше неравенство сводится к
ln (Te / T) ≥ 1 – T / Te ® x = T / Te и –ln x ≥ 1 – x, или ln x ≤ x – 1.
Если на плоскости x, y построить логарифмическую кривую y = ln x и провести прямую линию y = x – 1, то из графика на рисунке видно, что кривая лежит ниже прямой и лишь в точке (1, 0) они касаются.
Итак, в приведенном выше неравенстве знак «равно» имеет место только при T = Te. Во всех остальных случаях (ниже температура воды или выше) выполняется строгое неравенство. Процесс теплообмена является неравновесным.
1.14. Свободная энергия F задана в естественных (канонических) переменных T и V. Следовательно, выражения для F достаточно для определения любой термодинамической характеристики системы. Из основного термодинамического тождества
TdS = dU + PdV
можно вывести выражение для приращения dF через приращения ее естественных переменных dV и dT. Замена переменных в основном термодинамическом тождестве осуществляется с помощью преобразования Лежандра:
TdS =dTS – SdT.
Отсюда
dTS – SdT= dU + pdV Þ d(U – TS ) = – SdT – pdV º dF
В первую очередь рассмотрим частные производные свободной энергии по ее естественным переменным. В частности, давление является ее частной производной
p = – (¶F/¶V)T.
Вычисление его дает термическое уравнение состояния
p = RT/V.
Энтропия является частной производной свободной энергии по другой переменной
S = – (¶F/¶T)V.
Ее вычисление дает
S = – a +b + b∙lnT + R∙lnV.
Исходя из определения свободной энергии, находится внутренняя энергия
U = F + TS = bT + c.
Далее вычисляется теплоемкость при постоянном объеме
CV = T(¶S/¶T)V = b.
Проделанные вычисления подтверждают, что данная свободная энергия определяет термодинамику идеального газа. Можно убедиться, что и теплоемкость при постоянном давлении соответствует соотношению Майера
Cp = b + R.
1.15. Доказательство проводится для общего случая сред, характеризуемых объемом и давлением.
Наклон адиабат и изотерм определяется соответственно производными (¶р/¶V)S и (¶р/¶V)т. Следовательно, для решения задачи необходимо рассмотреть производную (¶р/¶V)S и перейти от независимых переменных S, V к переменным т, V. Наиболее быстро результат может быть получен, если перейти от частных производные к якобианам и учесть, что теплоемкость с = Т(¶S/¶т). Итак,
(¶р/¶V)S = ¶(S, р)/¶(S, V) = ¶(S, р)/¶(T, р) × ¶(T, р)/¶(T, V) × ¶(T, V)/¶(S, V) =
= (¶S/¶T)р×(¶р/¶V)T /(¶S/¶T)V = Cp/CV ×(¶р/¶V)T,
отсюда следует, что
(¶р/¶V)S £ (¶р/¶V)т < 0.
1.16. По определению теплоемкости и с учетом второго начала термодинамики
CV = (¶Q/¶T)V = T(¶S/¶T)V.
Поэтому, используя тот факт, что результат дифференцирования не зависит от последовательности дифференцирования, получаем:
(¶CV/¶V)T = T(¶2S/¶V¶T) = T¶(¶S/¶V)T/¶T = T(¶2p/¶T 2)V.
Здесь использовано, что (¶S/¶V)T = (¶p/¶T)V. Оно получается с помощью калибровочного соотношения ¶(T, S)/¶(p, V) = 1, а именно:
(¶S/¶V)T = ¶(T, S)/¶(T, V) = ¶(p, V)/¶(T, V) = (¶p/¶T)V.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.