Отношение потенциала для одинокого иона к потенциалу линейного приближения ~2.4, отношение потенциала для одинокого иона к потенциалу Больцмановского распределения ~2.6. Эти значения приближаются к числу e, но разница довольно велика, что, видимо, является следствием предположения о том, что до расстояний 1e-7м объемный заряд не оказывает влияние. Чтобы избежать этого эффекта, необходимо «сдвинуть» радиус Дебая вправо относительно левой границы модели.
Аномалии электропроводности электролитов.
Межионное взаимодействие при неравновесных процессах, в частности при прохождении электрического тока через растворы электролитов (явление электропроводности), должно иметь иной характер, чем в условиях равновесия.
В действительности при концентрации электролита, отличной от нуля, в растворе проявляются силы, которые тормозят движение ионов и, следовательно, уменьшают его эквивалентную электропроводность на величины λi, каждая из которых отвечает определенному типу сил взаимодействия. На этом основании вместо уравнения (V-4) можно написать

где Σλi, —суммарное уменьшение эквивалентной электропроводности раствора за счет всех эффектов взаимодействия, проявляющихся в реальных растворах. Происхождение одного из этих эффектов становится понятным, если учесть, что при наложении внешнего поля центральный ион и ионная атмосфера (как обладающие зарядами, одинаковыми по величине, но обратными по знаку) должны двигаться в противоположных направлениях (рис. 15).
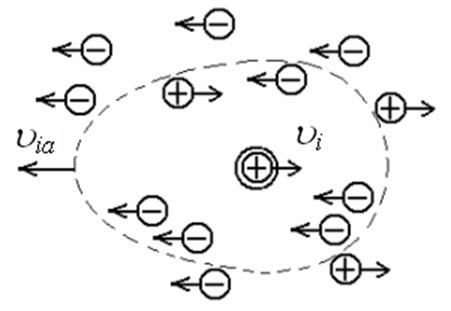
Рис.15 Движение центрального иона и ионной атмосферы в электрическом поле.
Так как все ионы гидратированы, движение центрального иона co скоростью ui происходит не в неподвижной среде, а в среде, перемещающейся в противоположном направлении со скоростью uia . Сила трения, как известно, пропорциональна скорости движения частицы и в реальном растворе ее величина определяется уравнением
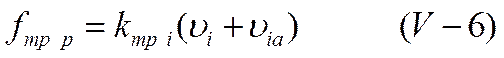
в то время как для идеального раствора она равнялась бы
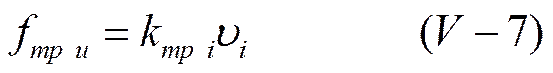
где kтр — коэффициент внутреннего трения.
Уменьшение электропроводности должно быть пропорционально возросшей силе трения. Если обозначить через λI изменение эквивалентной электропроводности раствора, обусловленное этим эффектом, то

ИЛИ
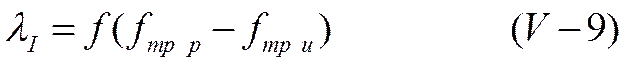
Дополнительная сила трения, связанная с существованием ионной атмосферы и ее перемещением в сторону, противоположную движению центрального иона, была названа электрофоретической силой трения, а вызванный ею эффект торможения — электрофоретическим эффектом.
Другой тормозящий эффект также связан с существованием ионной атмосферы и ее влиянием на движение ионов. Было установлено, что образование и разрушение ионной атмосферы протекает с большой, но с конечной скоростью. Характеристикой этой скорости служит так называемое время релаксации τr, которое можно рассматривать как величину, обратную константе скорости создания или разрушения ионной атмосферы.
Время релаксации зависит от ионной силы раствора, его вязкости и диэлектрической постоянной и выражается уравнением

где kтр — коэффициент внутреннего трения раствора; k — константа Больцмана; Т — абсолютная температура и χ — характеристическая длина по теории Дебая и Гюккеля. Для водного раствора 1-1 валентного электролита уравнение (V-10) упрощается и время релаксации можно приближенно рассчитать по уравнению
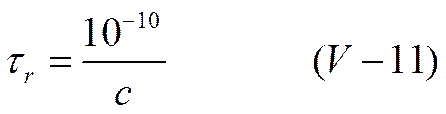
где с — концентрация электролита.
При перемещении центрального иона проходит какое-то время, пока старая ионная атмосфера разрушится и возникнет новая. Поэтому позади иона будет всегда находиться некоторый избыток заряда противоположного знака, и возникающие электрические силы притяжения будут тормозить его движение. Этот эффект торможения называется релаксационным. Если изменение эквивалентной электропроводности, связанное с релаксационным эффектом, обозначить через λ II , то уменьшение электропроводности при переходе от нулевой концентрации (идеальный раствор) к концентрации с дается уравнением

в котором учитываются и электрофоретический, и релаксационный эффекты.
Эффект Вина и дисперсия электропроводности
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.