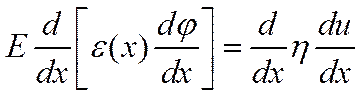
После интегрирования:
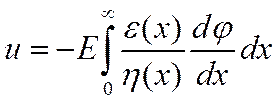
Метод Гитторфа. Для определения чисел переноса было предложено несколько методов. Первым из них был метод, разработанный Гитторфом и усовершенствованный позднее Финдлеем, Кистяковским и др.
Метод Гитторфа основан на общем уравнении чисел переноса
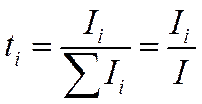
![]()
и использует то обстоятельство, что при прохождении через электрохимическую систему постоянного тока и обусловленного им направленного движения ионов изменяется состав раствора вблизи электродов. Количество переместившихся грамм-эквивалентов данного сорта ионов связано с переносимой ими долей тока и может быть представлено в виде отношения (-Il/F)τ, где τ — промежуток времени, в течение которого ток проходил через систему. Точно так же записывают и общее число перенесенных грамм-эквивалентов (фарадеев) электричества
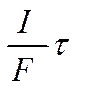
Уравнение для числа переноса данного сорта ионов будет поэтому иметь следующий вид:
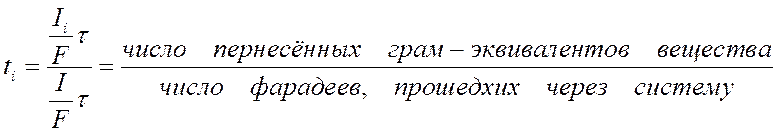
![]()
Число перенесенных грамм-эквивалентов вещества можно найти аналитически по изменению состава раствора вблизи каждого из электродов. Общее количество прошедшего электричества определяют обычно кулонометрически.
Пусть имеется электрохимическая система Hg, К ½КСl½ К, Hg, через которую пропускают ток в направлении, указанном стрелкой. Левый электрод — анод, а правый — катод. На аноде происходит растворение калия и переход его ионов в раствор. Ионы калия двигаются по направлению к катоду и разряжаются на нем с образованием амальгамы. От катода к аноду, т. е. в направлении, противоположном движению ионов калия, перемещаются ионы хлора. Перемещение обоих сортов ионов происходит в соответствии с их числами переноса. Схема процессов, протекающих в системе при пропускании одного фарадея электричества, может быть написана в следующем виде:
|
Анодное пространство |
Катодное пространство |
|
|
Электродная реакция |
К→К+ |
К+→К |
|
Перенос……………… |
-t+K++t-Cl- |
+t+K+-t-Cl- |
|
Суммарно…………… |
-K+(1-t+)K++t-Cl- |
+K-(1-t+)K+-t-Cl- |
|
или иначе…………… |
-K+t-K++t-Cl- |
+K-t-K+-t-Cl- |
поскольку в растворе присутствует лишь бинарный 1-1 валентный электролит, для которого в согласии с уравнением (IV-34)
![]()
Из приведенной схемы, так называемой схемы электродных балансов, следует, что в результате прохождения через систему одного фарадея электричества один грамм-атом калия перейдет с анода на катод, а количество хлорида калия одновременно увеличится у анода на t_ г-экв и уменьшится на ту же величину в катодном пространстве. Если начальная концентрация КСl была с0 , объемы анолита V0и католита Vk , то концентрации в анодном са и в катодном ск пространствах (предполагается, что объемы анолита и католита больше толщины слоя раствора, в котором происходит процесс диффузии) после прохождения одного фарадея электричества будут соответственно
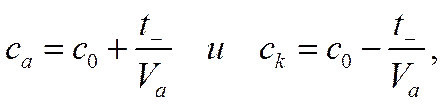
![]()
откуда
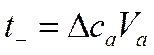 и
и 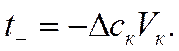
Если число Фарадеев равно z, то
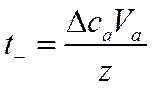 и
и 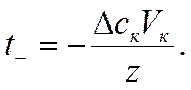
![]()
Следовательно, в согласии с уравнением (IV-38) для определения чисел переноса ионов по методу Гитторфа необходимо знать общее количество Фарадеев протекшего электричества и число грамм-эквивалентов перенесенного вещества.
В случае применения нерастворимого платинового анода вместо растворимого амальгамного
Pt | КСl | К, Hg
|
Анодное пространство |
Катодное пространство |
|
|
Электродная реакция |
Cl-→½Cl2 |
К+→К |
|
Перенос……………… |
-t+K++t-Cl- |
+t+K+-t-Cl- |
|
Суммарное…………… |
-t+KCl+½Cl2 |
-t-KCl+K |
на нем будет выделяться хлор, и электродные балансы следует записать по иному
Здесь концентрация вещества уменьшается и в анодном, и в катодном пространствах. Сохраняя прежние обозначения, теперь можно написать
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.