По Изгарышеву, у обращенной к раствору поверхности металла можно найти и ионы металла, и адсорбированные молекулы воды (рис. 29). Ионы металла могут переходить из водной фазы в металлическую, теряя при этом свою гидратную оболочку и входя в состав кристаллической решетки. В то же время молекулы воды (или другого растворителя), адсорбируясь и ориентируясь определенным образом на границе раздела двух фаз, могут взаимодействовать с ионами, находящимися в металле, и при известных условиях вырывать их из металлической решетки. Следовательно, величина электродного потенциала
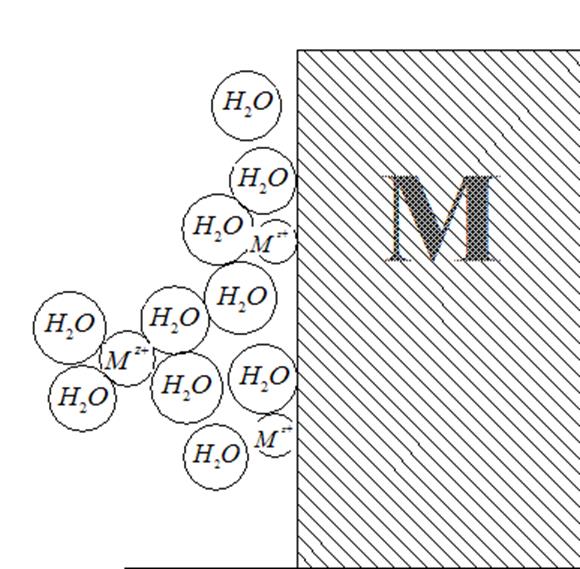
Рис. 29. Модель пограничного слоя металл-раствор при возникновении скачка потенциала на этой границе, по Н.А. Изгарышеву
должна зависеть от прочности связи иона в металле и энергии гидратации иона.
Рассмотрим
границу металл – раствор. Следуя Герни, будем считать, что вероятность перехода
металлического иона из раствора на металл (прямой переход) пропорциональна
числу металлических ионов, контактирующих со стороны раствора с поверхностью
металла (рис. 29), а вероятность обратных переходов пропорциональна числу
молекул растворителя, находящихся на поверхности металла. Герни полагал, что
если nL—
число молекул растворителя, a Nm — число ионов во всем объеме раствора, то для числа прямых
переходов ![]() и обратных переходов
и обратных переходов ![]() можно написать
можно написать
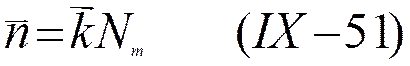
и
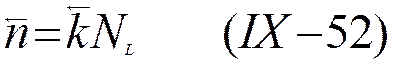
Так как
энергетические уровни иона в растворе и в металле неодинаковы, то коэффициенты
пропорциональности ![]() и
и ![]() должны быть функциями изменения энергии
при переходе иона из одной фазы в другую. Эти изменения энергии можно оценить
при помощи диаграммы, представленной на рис. 30. Здесь левая потенциальная
кривая отвечает изменению свободной энергии иона как функции расстояния между
ионом и гидратирующими его молекулами воды; положение молекул воды считается
при этом заданным и отмечено пунктирной вертикальной линией. Горизонталь uL соответствует низшему колебательному
уровню иона в растворе, горизонталь U0 — энергетическому
уровню свободного газообразного иона. Правая потенциальная кривая показывает
изменение энергии металлического иона как функции его расстояния от
неподвижной поверхности металла. Горизонталь Um на этой кривой отвечает низшему колебательному уровню иона в
поверхностном слое металлической решетки. Для прямого перехода ион должен
обладать таким запасом энергии, который позволил бы ему подняться с уровня uL на уровень U0 (обозначим
это количество энергии через
должны быть функциями изменения энергии
при переходе иона из одной фазы в другую. Эти изменения энергии можно оценить
при помощи диаграммы, представленной на рис. 30. Здесь левая потенциальная
кривая отвечает изменению свободной энергии иона как функции расстояния между
ионом и гидратирующими его молекулами воды; положение молекул воды считается
при этом заданным и отмечено пунктирной вертикальной линией. Горизонталь uL соответствует низшему колебательному
уровню иона в растворе, горизонталь U0 — энергетическому
уровню свободного газообразного иона. Правая потенциальная кривая показывает
изменение энергии металлического иона как функции его расстояния от
неподвижной поверхности металла. Горизонталь Um на этой кривой отвечает низшему колебательному уровню иона в
поверхностном слое металлической решетки. Для прямого перехода ион должен
обладать таким запасом энергии, который позволил бы ему подняться с уровня uL на уровень U0 (обозначим
это количество энергии через ![]() ). Тогда
). Тогда

и ![]() можно
рассматривать как энергию вырывания иона из раствора. Ион, совершающий
обратный переход, должен подняться с уровня Um на уровень U0. Пусть
можно
рассматривать как энергию вырывания иона из раствора. Ион, совершающий
обратный переход, должен подняться с уровня Um на уровень U0. Пусть

тогда ![]() будет
энергией, необходимой для проведения этого процесса; ее можно определить как
работу выхода иона из металла.
будет
энергией, необходимой для проведения этого процесса; ее можно определить как
работу выхода иона из металла.
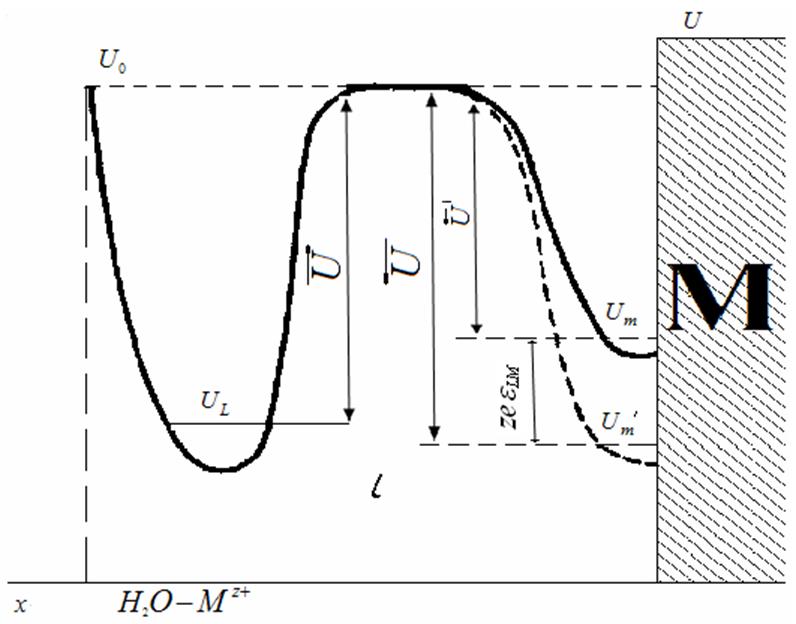
Рис. 30. Потенциальная диаграмма Герни
Предположив, что к распределению ионов по энергетическим уровням применима статистика Максвелла — Больцмана, можно вместо (IX-51) и (IX-52) написать уравнения, в которых учтено изменение энергии иона при его прямых и обратных переходах
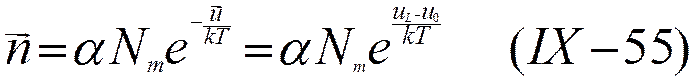
и
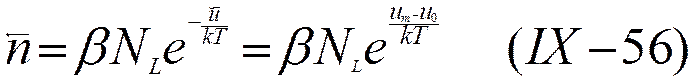
где α и β — факторы вероятности перехода.
Обычно в момент погружения металла в
раствор ![]() , т. е. наблюдается преимущественный
переход ионов в одном направлении. В результате этого возникает скачок
потенциала между металлом и раствором, который, в свою очередь, изменяет
энергетические состояния ионов. С течением времени, при достижении равновесия,
частоты переходов ионов в обоих направлениях выравниваются
, т. е. наблюдается преимущественный
переход ионов в одном направлении. В результате этого возникает скачок
потенциала между металлом и раствором, который, в свою очередь, изменяет
энергетические состояния ионов. С течением времени, при достижении равновесия,
частоты переходов ионов в обоих направлениях выравниваются
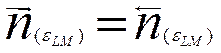
где eLM—равновесный скачок потенциала между металлом и раствором.
Предположим, следуя Герни, что энергия, связанная с возникшим потенциалом, изменит энергетическое состояние ионов, расположенных на поверхности металла. В этом случае уровень Um опустится на величину zeeLM , как это показано на рис. 30 пунктирной кривой. Число обратных переходов тогда определится уравнением
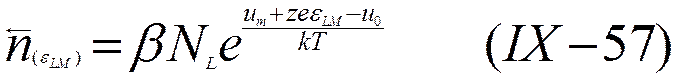
Поскольку 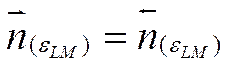 , то
, то
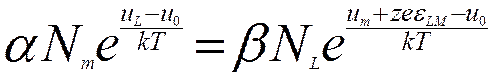
и
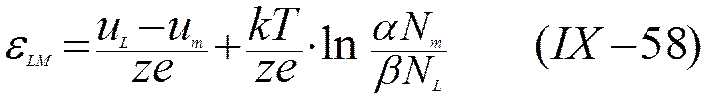
Уравнение (IХ-58) передает зависимость скачка потенциала металл — раствор от соотношения низших колебательных уровней металлического иона в растворе и металле, а также от концентрации раствора. Отношение числа растворенных частиц к числу молекул растворителя Nm/NL можно рассматривать как величину, пропорциональную концентрации, выраженной, например, в г·ион/л. Как следует из уравнения (IX-53) и (IX-54), а также из рис. 30,
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.