Обозначив величину RT/kтрчерез D, получим
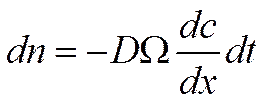
![]()
Уравнение (VI-6) называется первым законом Фика.
Коэффициент D, называемый коэффициентом диффузии (коэффициент
диффузии, отнесенный к молярным количествам, будет в Naраз меньшим, т. е. равным 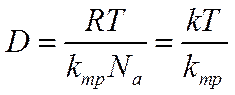 ), имеет размерность см2 ·сек -1
и показывает число частиц, продиффундировавших за 1 сек.через поперечное сечение раствора площадью 1 см2.
), имеет размерность см2 ·сек -1
и показывает число частиц, продиффундировавших за 1 сек.через поперечное сечение раствора площадью 1 см2.
При выводе первого закона Фика предполагалось, что градиент концентрации не меняется с течением времени и зависит только от величины х. Первый закон Фика относится, таким образом, к процессу стационарной диффузии. Однако диффузия далеко не всегда протекает в условиях стационарности. Так, например, если в трубке слева находится источник частиц, например твердое вещество, способное растворяться в жидкости, наполняющей трубку, то концентрация раствора будет изменяться и в пространстве, и во времени. При этом концентрация в области источника будет максимальной, а фронт концентрированного раствора передвигается слева направо.
В элементарный слой dх за время dtвойдет число частиц
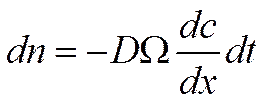
Выйдет из него за то же время dtчисло частиц dn', равное
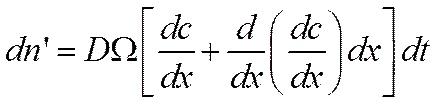
так как градиенты концентрации у правой и у левой границ элементарного слоя отличаются на величину
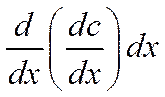
В элементарном слое dxостанется поэтому число частиц
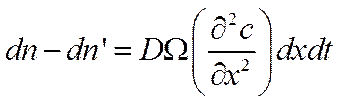
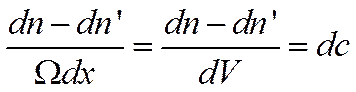
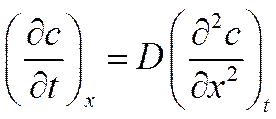
![]()
Уравнение (VI-7) представляет собой общее дифференциальное уравнение процесса диффузии и является математическим выражением второго закона Фика.
Учет особенностей диффузии в электролитах
При выводе законов Фика не было сделано никаких предположений о природе растворенного вещества, поэтому их вполне можно применить к описанию процесса диффузии электролитов. Так, используя уравнение (VI-3), можно написать для скорости диффузии положительных ионов u+ и отрицательных ионов u_ соответственно
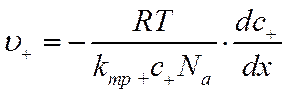
![]()
и
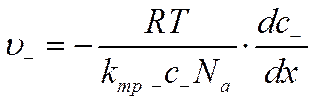
![]()
Учитывая, что подвижности
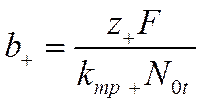
и
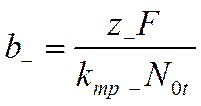
вместо уравнений (VI-8) и (VI-9) получим
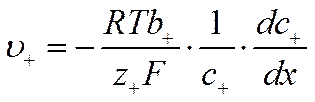
![]()
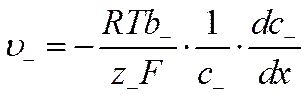
![]()
На основании уравнений (VI-6), (VI-10) и (VI-11) число положительных грамм-ионов, диффундирующих через сечение Ω за время dt, будет равно
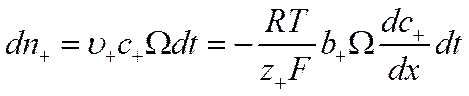
![]()
а число отрицательных грамм-ионов соответственно
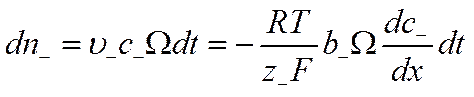
![]()
Из выражений (VI-12), (VI-13) и (IV-21) следует,
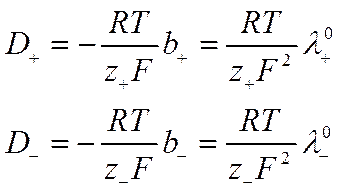
![]()
![]()
Где D+ и D_ — коэффициенты диффузии катионов и анионов, имеющие ту же размерность, что и коэффициент диффузии D (см2 ·сек -1).
В общем случае подвижности
катионов и анионов неодинаковы а следовательно, не равны и их коэффициенты диффузии 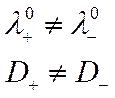 . Поэтому при одном и том же градиенте концентрации скорость диффузии положительных и отрицательных
ионов различна. Если предположить,
что создана граница между двумя растворами
соляной кислоты, концентрации которых равны соответственно с и с — dc, то в сторону разбавленного
раствора продиффундирует за данный отрезок времени больше ионов водорода, чем хлора, поскольку
. Поэтому при одном и том же градиенте концентрации скорость диффузии положительных и отрицательных
ионов различна. Если предположить,
что создана граница между двумя растворами
соляной кислоты, концентрации которых равны соответственно с и с — dc, то в сторону разбавленного
раствора продиффундирует за данный отрезок времени больше ионов водорода, чем хлора, поскольку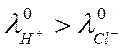 В результате этого возникает разность потенциалов
между концентрированным и разбавленным растворами, причем последний в данном случае окажется заряженным положительно (во всех случаях разбавленный раствор будет приобретать заряд более подвижного
иона). Возникшая разность потенциалов будет
тормозить движение быстрых ионов
водорода и ускорять движение медленных ионов
хлора. В результате дальнейшего роста потенциала скорость движения ионов
сделается равной, и диффузия электролита будет проходить подобно диффузии недиссоциированных молекул. Возникшая внутри раствора стационарная разность
потенциалов, вызванная различной
подвижностью ионов, называется диффузионным
потенциалом jd.
В результате этого возникает разность потенциалов
между концентрированным и разбавленным растворами, причем последний в данном случае окажется заряженным положительно (во всех случаях разбавленный раствор будет приобретать заряд более подвижного
иона). Возникшая разность потенциалов будет
тормозить движение быстрых ионов
водорода и ускорять движение медленных ионов
хлора. В результате дальнейшего роста потенциала скорость движения ионов
сделается равной, и диффузия электролита будет проходить подобно диффузии недиссоциированных молекул. Возникшая внутри раствора стационарная разность
потенциалов, вызванная различной
подвижностью ионов, называется диффузионным
потенциалом jd.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.