Это двухстадийный процесс. Первая стадия – диссоциация галогеналкана на ионы (мономолекулярная реакция):
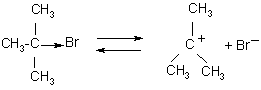
карбкатион – стабилизирован
внутримолекулярными электронными эффектами (+I эффект)
Далее карбкатион быстро реагирует с молекулами реагента или растворителя, способными предоставлять пару электронов для заполнения вакантной орбитали положительно заряженного углеродного атома.
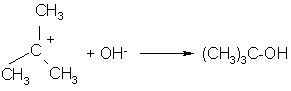 -
эта стадия реакции протекает быстро
-
эта стадия реакции протекает быстро
ОН- - реагент
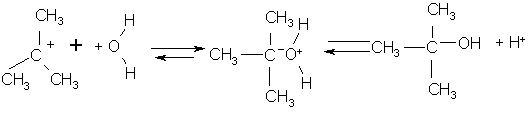 - процесс H2O – растворитель
протекает быстро
- процесс H2O – растворитель
протекает быстро
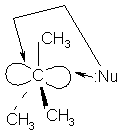 Карбкатион
имеет плоское строение, поэтому он атакуется нуклеофилом равновероятно с обеих
сторон образуются продукты – спирты одинаковой конфигурации с исходным
бромалканом, и обратной конфигурации т.е. образуется эквимолекулярная смесь
анантиомеров (рацемическая смесь).
Карбкатион
имеет плоское строение, поэтому он атакуется нуклеофилом равновероятно с обеих
сторон образуются продукты – спирты одинаковой конфигурации с исходным
бромалканом, и обратной конфигурации т.е. образуется эквимолекулярная смесь
анантиомеров (рацемическая смесь).
Реакционная способность галогеналканов в реакциях SN1 изменяется в обратном порядке по сравнению с SN2.
Третичный > вторичный >> первичный > СН3
Таким образом реакция замещения SN2 характерна для СН3X и первичных галогенпроизводных, а SN1 для третичных. В случае вторичных галогеналканов наблюдается смешанный механизм реакции.
Активность галогенопроизводных возрастает с увеличением молекулярной массы галогена: атом йода более подвижен чем хлора. Это связано с тем, что по мере увеличения размера атома уменьшается прочность связи между ядром и электронами внешней электронной оболочки, участвующими в образовании связи С-X. В ряду связей С-F, С-Cl, С-Br, С-I реакционная способность в процессах SN возрастает, поскольку в этом ряду увеличивается длина связи С-X, ее поляризуемость и легкость отщепления галогена.
Если атом галогена находится у ненасыщенного атома углерода или связан с углеродным атомом бензольного кольца, например, в молекулах винилхлорида (СН2=СНСl) или хлорбензола (С6Н5Сl), где С – атомы находятся в sp2 – гибридизации, происходит сопряжение орбиталий π- электронов двойной связи или бензольного ядра с НЭП атома галогена (+М эффект). Поэтому подвижность атома галогена в таких соединениях резко снижается. Если же галоген находится у атома углерода, расположенного в
α –положении к двойной связи (СН2=СН–СН2Cl - аллилхлорид) «аллильное» положение или – к углеродному атому бензольного кольца (С6 Н5 СН2Cl - бензилхлорид) – «бензильное» положение, то этот галоген обладает повышенной реакционной способностью в реакциях SN1. Это связано с более легкой диссоциацией связи С-X и дополнительной стабилизацией катиона за счет сопряжения.
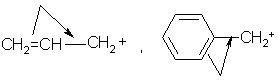
Когда атом галогена еще больше удален от двойной связи или бензольного кольца, то он по своей реакционной способности не отличается от галогеналканов, например,
CH2=CH-(CH2)4-CH2-Cl; С6Н5-СН2-СН2-СН2-Cl
7-хлор-1-гептен 1-хлор-3-фенилпропан
При проведении реакции нуклеофильного замещения подбирают такой растворитель, в котором растворяются оба реагирующих вещества и который способствует разрыву связи С-X.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.