Реакции нуклеофильного замещения в галогенах могут протекать по двум механизмам: SN1 – реакции мономолекулярного нуклеофильного замещения и SN2 – реакции бимолекулярного нуклеофильного замещения.
Реакции SN2 протекают при действии на субстраты* сильных нуклеофильных реагентов.
Одним из характерных примеров реакции SN2 является щелочной гидролиз метилбромида:
CH3-Вr + NaOH → CH3OH + NaBr
(NaOH + H2O)
Механизм реакции:
Скорость реакции SN2 подчиняется кинетическому уравнению второго порядка:
V = K[CH3Br][OH-]
т.е. пропорциональна концентрации субстрата и нуклеофилов – -ОН.
Таким образом в данной реакции в стадии, определяющей ее скорость, участвуют две частицы – Гидроксид – ион и метилбромид.
__________
*Субстрат – это один из реагентов, имеющий, как правило, более сложное строение.
Гидроксид – анион атакует атом углерода, имеющий частичный положительный заряд, со стороны, противоположной атому брома («с тыла»), как пространственно наиболее доступной стороны:
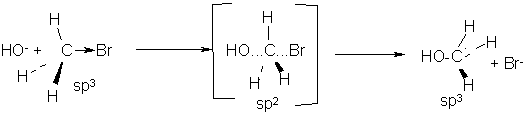
переходное состояние
(активированный комплекс)
По мере приближения к углеродному атому нуклеофильного реагента, последний оказывает все большее влияние на атомы водорода метильной группы – отталкивая их, что сопровождается постепенным удалением этих атомов друг от друга (атомы «раздвигаются»). В переходном состоянии атом углерода и три атома водорода метильной группы располагаются в одной плоскости, перпендикулярной плоскости доски. Угол между связями составляет 120ºС (sp2 - гибридизация). В переходном состоянии образование связи углерод – кислород и разрыв связи углерод – бром происходят одновременно. Отрицательный заряд в этом переходном состоянии распределен между вступающей (OH-) и уходящей (Br-) группами, а атом углерода остается практически незаряженным. Углы между связями в молекуле CH3ОН составляют, как и в субстрате, 109º (sp3 - гибридизация), но при этом происходит обращение конфигурации на противоположную (инверсия).
В реакциях SN2 реакционная способность галогеналканов определяется главным образом пространственными факторами и снижается с увеличением числа заместителей у атома углерода, связанного с галогеном:
СН3Х >СН3СН2Х>(СН3)2СНХ>>(СН3)3СХ
галогеналканы первичные вторичные третичные
галогеналканы галогеналканы галогеналканы
Реакции SN1 принципиально отличаются от реакций SN2 . Реакции SN1 часто протекают при действии на субстраты слабыми нуклеофильными реагентами, которые, как правило, являются и растворителями. Так, при использовании в качестве растворителя воды или спиртов протекают реакции гидролиза или алкоголиза соответственно. Примером реакции SN1 может быть, гидролиз трет – бутилбромида:
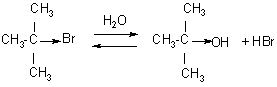
Механизм реакции:
В данном случае скорость реакции не зависит от концентрации воды, т.к. нуклеофил не участвует в первой стадии процесса. Реакция SN1 идет в соответствии с кинетическим уравнением 1 – го порядка V=K[(CH3)3CBr].
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.