тионил
При использовании в качестве галогенирующего реагента галогеноводорода необходимо применять водоотнимающее средство (например CaCl2), которое связывает образующуюся воду и предотвращает гидролиз полученных галогеноалкилов.
В реакциях с РСl5 в качестве побочного продукта образуется хлорокись фосфора- жидкое вещество как и целевой продукт С2Н5Сl. Поэтому разделение этих двух жидкостей составляет дополнительные технологические трудности.
Наиболее удобно использовать в этих реакциях хлористый тионил, так как побочные продукты SO2 и НСl являются газообразными веществами, которые легко удаляются от основного продукта C2H5Cl.
4. Физические свойства
Физические свойства галогенопроизводных зависят от строения радикала (линейное или разветвленное), вида и количества атомов галогена в молекуле. В частности, для моногалогенопроизводных температура кипения и плотность возрастают с увеличением длины углеродной цепи и при переходе от фтора к йоду. Дигалогенопроизводные представляют собой тяжелые масла или твердые вещества.
Все галогенопроизводные в воде практически не растворяются, но хорошо растворяются в органических растворителях. Они имеют специфический, как правило резкий запах, раздражающий слизистую оболочку. Некоторые из них обладают анестезирующим действием (СН2Сl2, СНСl3), токсичны и являются антисептиками (СНI3).
5. Химические свойства
Галогенопроизводные углеводородов являются одним из наиболее реакционноспособных классов органических соединений. Наиболее характерны для этого класса соединений реакции нуклеофильного замещения (SN) и отщепления (элиминирования, Е). Высокая реакционная способность галогенопроизводных в этих реакциях обусловлена строением их молекул. Так, в молекуле СН3Сl ковалентная связь между атомом углерода и галогеном поляризована из-за большой электроотрицательности атома хлора (-I- эффект). Поэтому электронная плотность у атома углерода понижается:
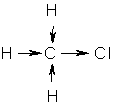
Вследствие этого углеродный атом легко атакуется молекулами или ионами, представляющими свою электронную пару (нуклеофильный реагент) для образования новой связи. Электроны разрывающейся связи уходят вместе с освобождающимся ионом:
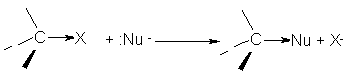 - (нуклеофильное замещение SN)
- (нуклеофильное замещение SN)
Субстрат нуклеофил продукт уходящая группа
Нуклеофильными реагентами называют атомы или группы атомов, а также молекулы, которые являются донорами электронной пары при образовании связи с любым элементом, кроме водорода.
Нуклеофильные реагенты (примеры)
а) отрицательно заряженные ионы:
:OH-, :I-, :CN-, CH3O:-, CH3C(O)O:-, :Br-, :Cl-
б) нейтральные молекулы, имеющие неподеленную электронную пару (НЭП) на гетероатомах:
H2O, CH3OH, NH3, CH3NH2, C6H5OH, C6H5NH2
реакционная способность галогеналканов в реакциях нуклеофильного замещения зависит от нескольких факторов:
а) от строения углеводородного радикала (линейное или разветвленное);
б) от галогена;
в) от атакующего нуклеофила;
г) от условий реакции (температура, наличие или отсутствие катализатора);
д) от характера растворителя, в котором идет реакция.
Указанные факторы влияют и на механизм реакции.
1. Реакции нуклеофильного замещения (SN1 и SN2)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.