
















16. Характеристика способів та видів теплової обробки страв з м'яса: теоретичне обґрунтування параметрів процесу, фактори та сутність фізико-хімічних процесів, що обумовлюють зміни маси, консистенції, харчової цінності, кольору та аромату; норми втрат при тепловій обробці
1. Сутність фізико-хімічних процесів, що обумовлюють зміни маси, консистенції, харчової цінності, кольору та аромату; норми втрат при тепловій обробці.
Зміна білків м'яса в процесі нагріву. Білкова молекула при нагріванні піддається складним фізико-хімічним змінам, перш за все денатурації і коагуляції, глибина яких залежить від температури, тривалості теплової обробки і деяких інших факторів. При вивченні всіх класів білків необхідно встановити рівні організації їх макромолекулярної структури. За термінологією Ліндерштрема-Ланга і Бернала ці рівні прийнято іменувати первинною, вторинною, третинною і четвертинною структурою білка. Під первинною структурою розуміють вид, число і послідовність з'єднання амінокислотних залишків у поліпептидному ланцюзі білка, під вторинною - взаємозв'язок і характер спіралізації поліпептидних ланцюгів, під третинною - закономірне згортання ланцюгів, що володіють вторинною структурою в макромолекулі, під четвертинної - агрегацію макромолекул.
Будь-яка зміна, що розглядається як взаємодія білків один з одним, передбачає попереднє руйнування цих зв'язків, якими вони утримуються в системі, і заміну їх іншими. Утворення нових випадкових структур у складних білкових системах представляється як наслідок заміни лабільних зв'язків між білковими частинками більш стабільними зв'язками. Якщо вплив тих чи інших чинників призводить до руйнування третинної або четвертинної стриктури, то послаблюється захисна дію гідратаційних шарів поблизу полярних угруповань та утворення нових більш міцних структур стає неминучим. Зменшення гідрофільної і збільшення гідрофобної здатності і, отже, зниження захисної (стабілізуючої) дії гідратаційних шарів поблизу полярних угруповань відбуваються в результаті внутрішньо молекулярної перебудови білкової молекули при денатурації. У цих умовах відбувається агрегування білкових частинок за рахунок міжмолекулярних сил і коагуляція білка.
У світлі таких уявлень розглянемо питання про єство і механізм денатурації білків. Денатурація, на думку Жолі, - це будь-яка модифікація вторинної, третинної або четвертинної структури білкової молекули, за виключенням розриву ковалентних зв'язків.
Вплив температури і способу нагрівання швидкість і температуру денатурації білків. Швидкість теплової денатурації залежить від температури, вологості, способу нагрівання й інших факторів.
Денатурація гальмується при додаванні певних речовин, таких, як пірофосфат, багатоатомні спирти, цукру і F-актин, хоча механізми гальмування різні. Швидкість Денатурації АТФази збільшується при розщепленні м'язового протеїну в результаті зменшення розміру, щільності і симетрії молекул. Швидкість денатурації білків залежить і від деяких інших чинників. Наприклад, денатурація фібриногену сечовиною прискорюється при збільшенні концентрації сечовини і при зниженні рН нижче 7, проте в інтервалі рН 7,0 ... 8,6 швидкість реакції майже постійна.
Присутність важкої води стабілізує нативну структуру ферментів, обумовлену наявністю водневих зв'язків, зменшуючи швидкість інактивації.
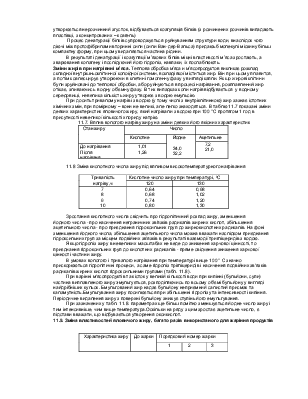
В даний час встановлено, що білки, що входять до складу м'яса, денатурують в міру досягнення визначеної для кожного білка температури. Найбільш чутливий до нагріву міозин. Температура денатурації 0С: міозину - 45 ... 50, актину - 50, актоміозина - 42 ... 48, міоальбумінів - 45 ... 47, глобулину - 50, міогену - 50 ... 60, колагену - 58 ... 62, міопротеїдів близько 100. В інтервалі температур 45 ...50°С денатурує головна частина структурних білків м'язів. Саркоплазматичні білки (міоген і міоглобін) денатурують при більш високих температурах (55 ... 65 °С). Найбільш стійкі до денатурації міопротеіди (більша частина ферментів), а також гемоглобін, сироватковий альбумін, колаген.
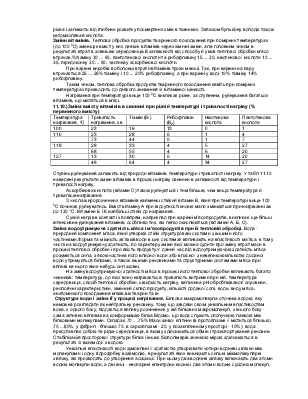
Встановлено, що денатурація відбувається ступінчасто, тобто при досягненні певної температури білком він набуває відповідну структуру з певними властивостями. Згідно з даними М. А. Калейджиєва, денатурація сироваткового альбуміну кролика здійснюється через три ступені. Зегель показав, що денатурація кристалічного альбуміну проходить через 4 ступені: перший ступінь наступає при температурі 60 °С, друга - 61 ... 65°С, третя лежить між 65 і 80°С, четверта-при температурі вище 85 °С.
Зміна заряджених груп і рН білків у процесі теплової обробки м'яса. У процесі теплової денатурації і подальшої коагуляції відбуваються структурні зміни білків, розрив колишніх та утворення нових зв'язків за участю водневих зв'язків, сульфгідрильних, дисульфідних, кислих і основних груп білків і гідрофобних взаємодій.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.