Белки, транспорт которых связан с участием комплекса Гольджи, синтезируются полирибосомами, связанными с ШЭР следующим образом
1. Рибосома начинает синтез N - концевой гидрофобной лидирующей (сигнальной) последовательности на цитоплазматической иРНК.
2. Сигнальные частицы, распознающие сигнальную последовательность (SRPs), состоящие из нескольких белков и небольшой (7SL) РНК, узнают лидирующие последовательности соответствующих синтезированных белков и связываются с ними, как только те покинут рибосомы. Это соединение временно останавливает трансляцию, до тех пор, пока N - концевая лидирующая последовательность, сошедшая с рибосомы не свяжется со специальным связывающим белком на ШЭР мембране.
3. Этот белок связывает рибосому с ШЭР, и лидирующая последовательность вставляется в ШЭР мембрану.
4. SRP отделяется и трансляция возобновляется.
5. Синтезируемый белок фактически протягивается через мембрану АТФ зависимым процессом.
6. Прежде, чем трансляция завершится, лидирующие последовательности удаляются связанной с мембраной протеазой. Белки высвобождаются в просвет ШЭР и подвергаются дальнейшей сортировке. Белки, которые остаются в эндоплазматическом ретикулуме, имеют устойчивые специальные сигнальные пептиды на С- концах и таким образом остаются связанными к мембраной ШЭР
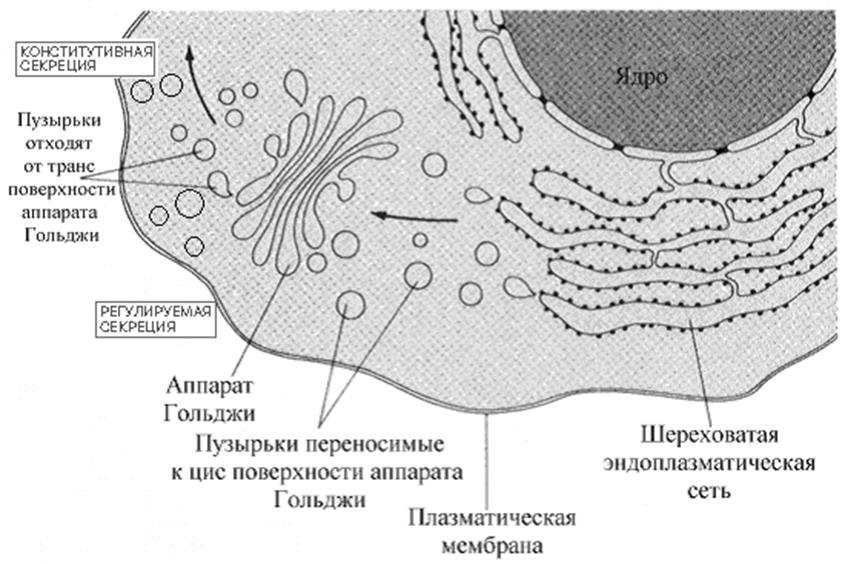 |
гликозилирования (см ниже). Пузырьки, несущие эти белки отпочковываются от ШЭР и перемещаются к комплексу Гольджи, где завершается достройка углеводной половины гликопротеинов. Мембранные пузырьки комплекса Гольджи - многослойная арена для сортировки модифицированных белков. Пузырьки от ШЭР поступают вначале на цис поверхность комплекса Гольджи (поверхность, расположенная ближе к ШЭР) и сливаются (объединяются) с мембраной цистерн Гольджи. Белки затем проходят снова через пузырьки, к промежуточным слоям. Наконец, часть пузырьков отшнуровывается от транс поверхности комплекса Гольджи (та, что дальше от ШЭР) и участвуют в формировании лизосом, пероксисом или глиоксисом или доставляются к плазматической мембране. Часть белков, обладающих специфической последовательностью (KDEL сигнальной последовательности (Лиз-Асп-Глу-Лей)) «отлавливается» рецепторами мембран аппарата Гольджи и в комплексе с рецептором возвращается в эндоплазматический ретикулум путем ретроградного транспорта.
Везикулярный транспорт белков от комплекса Гольджи требует высокой специфичности в целенаправленном перемещении. Нарушение везикулярного транспорта - причина клеточного хаоса. Мембраны везикул переносящих упакованные в пузырьки белки метятся специфичными белками мембран. В некоторых случаях мембраны пузырьков содержат комплементарные белки (называемые ловушками), которые взаимодействуют с другими мембранами и вызывают слияние мембран и точную доставку переносимых белков.
Секретируемые из клетки белки в составе пузырьков (везикулярный транспорт) могут покидать клетку несколькими путями. Различают конститутивную и регулируемую секрецию. В механизмах регулируемой секреции важное место отводится специальному белку клатрину (покрытые клатрином окаймленные пузырьки).
Клатрин - консервативный фибриллярный белок (18О кДа), образующий вместе с другим полипептидом (35 кДа) характерный многогранный чехол на поверхности так называемых окаймленных пузырьков. Основным структурным компонентом чехла служит трехвалентный белковый комплекс (трискелион ), состоящий из трех полипептидных цепей клатрина и трех меньших по размеру полипептидов. Трискелионы образуют на поверхности окаймленных пузырьков корзиноподобные сетки из шести- и пятиугольников. Выделенные трискелионы при соответствующих условиях способны к спонтанной агрегации. При этом даже в отсутствие пузырьков формируются типичные многогранные корзинки. Остальные белки, входящие в состав мембран окаймленных пузырьков, по-видимому, отвечают за связывание клатриновой оболочки с пузырьком и за улавливание рецепторов плазматической мембраны в окаймленные ямки и пузырьки.
В механизмах конститутивной секреции участвуют неклатриновые окаймленные пузырьки.
У бактерий свои особенности транспорта белков. Бактериальные белки, предназначенные для секреции (транслокация через клеточную мембрану) содержат высоко гидрофобные отрезки аминокислот (называемые сигнальными последовательностями или лидирующими последовательностями) на их N- концевой области. После того, как белок прошел через мембрану, лидирующая последовательность удаляется.
В настоящее время принятая модель транслокации показана на рис.10-14. Последовательность событий выглядит следующим образом:
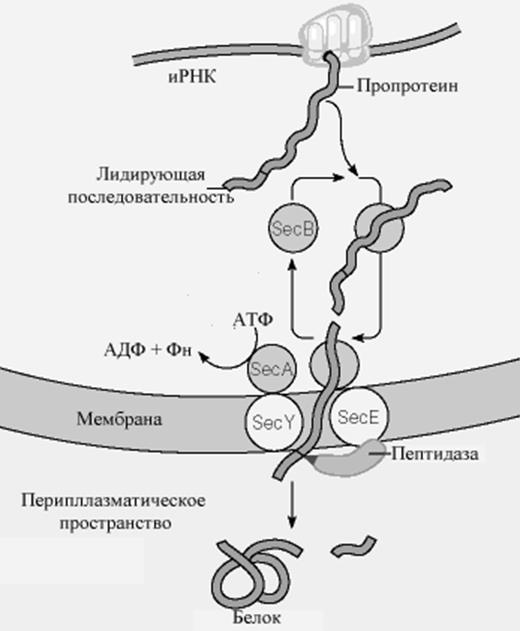 |
Рис.. Механизм переноса белков через мембрану у бактерий.
следняя состоит из двух трансмембранных белков, Sec E и Sec Y. Sec A - АТФаза, которая способствует транслокации. После того, как про-белок пройдет через мембрану, лидирующий пептид удаляется связанной с мембраной протеазой , и белок может свернуться в свою активную трехмерную форму.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.