Многие антибиотики, используемые для лечения бактериальных инфекций также как и некоторые токсины действуют путем ингибирования трансляции. Ингибирование может быть произведено на всех стадиях трансляции от инициации элонгации к терминации.
|
Некоторые Антибиотики и токсины - ингибиторы трансляции |
|
|
Ингибитор |
Действие |
|
Хлорамфеникол |
Ингибирует пептидилтрансферазу на большой субъединице рибосом прокариот |
|
Циклогексимид |
Ингибирует пептидилтрансферазу на большой субъединице рибосом эукариот |
|
Эритромицин |
Ингибирует транслокацию прокариотическими большими субъединицами |
|
Фузидиновая кислота |
Ингибирует элонгацию у прокариот путем связывания EF-G GDP, предотвращая диссоциацию его от большой субъединицы |
|
Пуромицин |
Аналог аминоацил-тРНК, вызывает преждевременную терминацию у прокариот и эукариот |
|
Стрептомицин |
Ингибирует инициацию роста пептидной цепи, способствует неправильному считыванию иРНК, у прокариот |
|
Тетрациклин |
Ингибирует связывание аминоацил тРНК к прокариотической малой субъединице |
|
Дифтерийный токсин |
Ингибирует связывание аминоацил - т-РНК к прокариотической маленькой субъединице Каталитически инактивирует eEF-2 путем АДФ- рибозилирования |
|
Рицин |
Смертельный растительный лектин. Найден в касторовом семени, катализирует распад рРНК большой субъединицы рибосом эукариот |
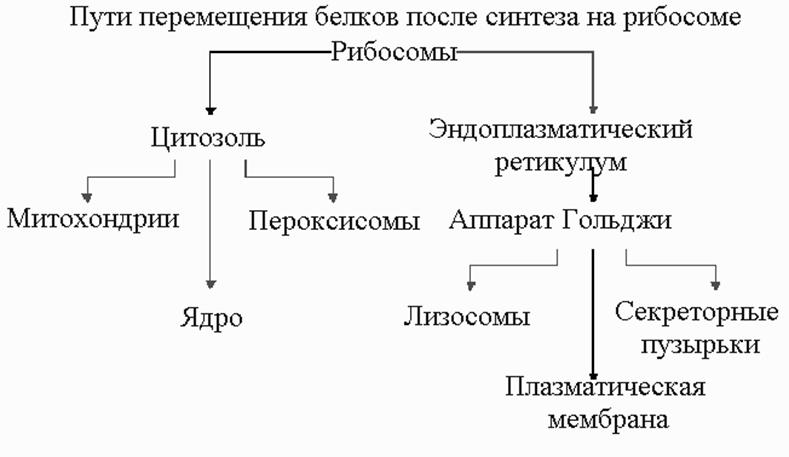 |
цифических белков. Лишь небольшая часть этих белков может быть синтезирована в пределах органеллы, а основная масса их синтезируется на рибосомах и нуждается в механизмах доставки этих белков. В цитоплазме клеток эукариот имеется две пространственно изолированные популяции рибосом. Одни из них ( рибосомы, связанные с мембраной ), расположены на обращенной к цитоплазме поверхности мембраны ЭР (шероховатый ЭР) и заняты синтезом белков, которые сразу же переносятся внутрь ЭР. Другие (свободные рибосомы) не прикреплены к мембранам и производят все остальные белки, кодируемые ядром. Связанные и свободные рибосомы идентичны по строению и функции. Они различаются только по белкам, которые синтезируются на них в каждый данный момент. Если рибосоме достается синтез белка с сигнальным пептидом для ЭР, то такой сигнал направляет рибосому к мембране ЭР.
Белки, синтезируемые свободными рибосомами – Это белки, предназначенные для цитоплазмы или для включения в митохондрии, хлоропласты или ядра. Вновь синтезированные белки, предназначенные для митохондрий (подобный механизм вероятен и для хлоропластов) содержат специфичные аминокислотные последовательности (то есть, сигнальные последовательности) на своих N - концевых отделах. Многие сигнальные пептиды таких белков имеют положительно заряженные аминокислотные остатки, которые чередуются с гидрофобными. Сигнальные последовательности не только обеспечивают встраивание белка в мембраны, но и выполняют роль сигналов, которые способствуют точному и целенаправленному переносу белка к месту его функционирования. Среди белков, направ
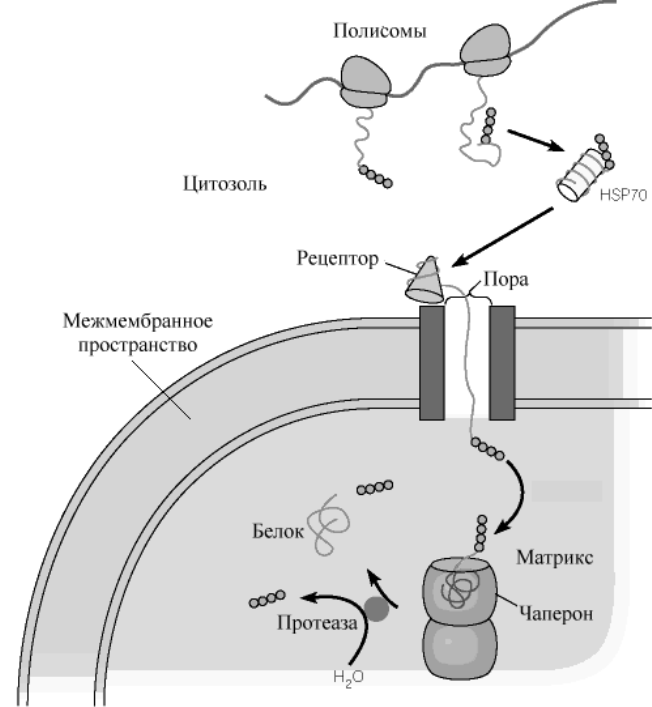 |
Рис .Белки теплового шока обеспечивают прохождение белков из цитозоля в матрикс митохондрий.
ляющихся в ядро, большинство имеет сигнальные пептиды, образованные кластером положительно заряженных аминокислотных остатков. Наконец, некоторым белкам цитозоля присущи сигнальные пептиды, с которыми ковалентно связывается жирная кислота, направляющая эти белки к мембранам Важную роль в механизме переноса таких белков принадлежит специальному классу белков, получивших название шапероны. Функция этих белков не ограничивается только участием в переносе белка. Шапероны состоят из нескольких полипептидных цепей, формирующих внутримолекулярную полость с рядом гидрофобных поверхностей внутри этой полости. Такая полость выполняет роль хранителя полипептидных цепей синтезированной молекулы от неправильного сворачивания и межмолекулярной агрегации. Наиболее хорошо изученные шапероны - члены семейства белков " теплового шока "(HSP) . Эти белки образуются у бактерий в ответ на тепловое воздействие. Они классифицируются, как правило, по молекулярным массам. Различают семейства HSP70, HSP60 и т.д. Белки при взаимодействии с шаперонами остаются развернутыми и доставляются к участку рецептора на мембране органеллы. Развернутый белок затем проходит через специальные ворота, расположенные во внутренней и внешней мембранах митохондрий. В процессе этого транспорта происходит специфическое узнавание белков, предназначенных для межмебранного пространства, мембран, или матрикса. Если комплекс проходит в матрикс, белок может быть принят внутриорганельными шаперонами для конечного сворачивания. N - концевая последовательность удаляется во время этого транспорта
Белки, синтезируемые на шереховатом эндоплазматическом ретикулуме- белки, предназначенные для клеточных мембран, лизосом, или внеклеточного транспорта используют специальную систему сортировки, вовлекающую шереховатый эндоплазматический ретикулум (ШЭР) и комплекс Гольджи. ШЭР - представлен сетью связанных между собой пузырьков, окруженных мембраной в пределах цитоплазмы. На внешней, цитозольной поверхности пузырьков располагаются полисомы, придающие мембране шереховатый вид. Комплекс Гольджи по строению напоминает ШЭР, он состоит из стека небольших, окруженных мембраной пузырьков, не связанных между собой и не покрытых рибосомами. Комплекс Гольджи действует как " переключающий центр " для белков различного предназначения.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.