Таким образом, благодаря триплет-триплетному связыванию
(кодон-антикодоновому взаимодействию) между мРНК и тРНК в рибосоме,
транслокация тРНК каждый раз приводит к протягиванию цепи мРНК относительно
рибосомы ровно на три нуклеотида. Рибосома перемещает тРНК однонаправленно из
А-участка на Р-участок, перемещение цепи иРНК оказывается тоже
однонаправленным. В процессе элонгации оно может происходить только в
направлении от 5'- к 3'-концу цепи. В целом получается, что при элонгации
рибосома работает как лентопротяжный механизм, перемещая с помощью тРНК цепь
мРНК относительно себя с шагом по три нуклеотида. Важно отметить, что в
процессе этого перемещения рибосома расплетает все попадающиеся на ее пути
двуспиральные участки и более сложные элементы вторичной и третичной структуры
мРНК.
У прокариот (бактерий) ДНК не отделена мембраной от цитоплазмы и рибосом, и
трансляция начинается на цепях иРНК во время ее синтеза на ДНК. Следует
отметить четкую временную слаженность этих двух процессов. Молекулы
РНК-полимеразы синтезируют цепи иРНК, начиная от 5'-конца РНК в направлении к
3'-концу, а рибосомы присоединяются к 5'-концевым участкам иРНК, инициируют
трансляцию и двигаются в процессе элонгации по направлению к молекуле
полимеразы.Такое явление получило название сопряженной транскрипции-трансляции.
В бактериальных клетках скорость синтеза РНК (транскрипции) - около 30-45
нуклеотидов в секунду при 370С, а скорость трансляции - около 10-15
триплетов в секунду, т.е. один триплет нуклеотидов синтезируется приблизительно
за то же время, за которое он прочитывается и образуется одна пептидная связь.
У эукариот сопряжение транскрипции и трансляции невозможно. ДНК (хромосомы)
эукариот отделены от цитоплазмы, содержащей рибосомы, ядерной мембраной.
Поэтому иРНК у эукариот синтезируется полностью в клеточном ядре и затем
транспортируется в цитозоль, где и встречается с рибосомами. Для инициации
трансляции иРНК эукариот требуется не только 5'-конец мРНК, но и готовая
3'-концевая часть, являющаяся "усилителем" инициации. В отличие от
бактерий скорость элонгации у эукариот варьирует в широких пределах, обычно от
1 до 10 триплетов в секунду, в зависимости от типа клеток, их физиологического
состояния и природы транслируемой мРНК
Постепенно перемещаясь по иРНК и удлиняя полипептидную цепь,
транслирующая рибосома доходит до конца кодирующей последовательности и
встречается с одним из трех триплетов, не кодирующих аминокислоты и
обозначаемых как терминирующие или стоп-кодоны - УАГ, УАА или УГА ( их
называли также незначащими, или бессмысленными, кодонами). После
заключительной транслокации пептидил тРНК на Р-участок рибосомы, на А-участке
устанавливается терминирующий кодон и в дело вступают специальные белки,
называемые факторами терминации, или факторами освобождения (release factors,
RF). Один из них, RF1 (или похожий на него RF2), взаимодействует
непосредственно с кодоном терминации в А-участке, а другой, RF3, при содействии
первого и с участием ГТФ - с большой субъединицей рибосомы и, возможно,
непосредственно с пептидилтрансферазным центром. Результатом связывания этих
факторов с рибосомой является активирование гидролазной активности
пептидилтрансферазного центра рибосомы, катализирующего реакцию взаимодействия
полипептидил-тРНК (донорный субстрат) с молекулой воды (акцепторным субстратом):
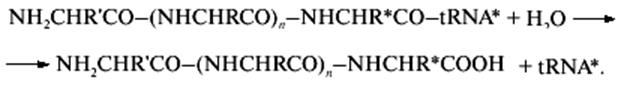
Связь между синтезированным полипептидом (его С-концом) и тРНК гидролизуется и полипептид покидает рибосому.
Заключительным актом терминации является выход деацилированной тРНК из Р-участка и диссоциация рибосомы на субчастицы. Диссоциация происходит спонтанно вследствие ослабления связи между двумя рибосомными субчастицами в отсутствие лигандов (пептидил-тРНК и аминоацил-тРНК), и у бактерий может значительно ускоряться под действием специального белка, называемого фактором освобождения рибосом.
После диссоциации терминировавшей рибосомы на субчастицы малая субчастица не обязательно покидает иРНК: она может задержаться на ней и в случае полицистронных мРНК у прокариот проскользнуть по цепи мРНК до начала следующей кодирующей последовательности и инициировать новую трансляцию (реинициация). Так как малая субчастица до инициации слабо удерживается на иРНК, то, если ей нечего реинициировать на этой же цепи мРНК, она скоро соскочит с нее и окажется среди пула свободных субчастиц цитоплазмы, готовых к инициации трансляции других иРНК.
Во время элонгации происходит и еще одно важное событие, оказывающее существенное влияние на будущую жизнь молекулы. Это формирование пространственной структуры
Поскольку в процессе элонгации новый аминокислотный остаток добавляется к С-концевой аминокислоте пептида, то по мере синтеза N-конец пептида все более отодвигается от пептидилтрансферазного центра рибосомы. На рибосоме может разместиться не более 10-30 аминокислотных остатков растущего полипептида, а полипептидные цепи синтезируемых рибосомой белков состоят из 100-300 аминокилот . Это значит, что через какое-то время после начала трансляции N-концевая часть растущего полипептида оказывается вне рибосомы и затем по мере роста полипептида все большая часть его свешивается с рибосомы в окружающую среду. В ней полипептидная цепь не может оставаться в виде развернутой цепи: ее гидрофобные боковые группы взаимодействуют друг с другом, а гидрофильные - с окружающей водой и ионами. Это создает условия для сворачивания, компактизации и самоорганизации внерибосомной части растущего полипептида в пространственную (вторичную и третичную) структуру. Сворачивание полипептида в компактную структуру происходит, таким образом, полярно, от N-конца к С-концу. Такое постепенное полярное сворачивание растущей полипептидной цепи на рибосоме обозначается как котрансляционное формирование структуры белка. В других случаях белок, синтезируемый рибосомой и используемый в других компартментах клетки необходимо перенести через мембрану либо вне клетки, либо в одну из внутриклеточных органелл. Транспорт такого белка через мембрану требует несвернутого состояния его полипептидной цепи. В этом случае могут быть использованы две альтернативные возможности: 1) рибосомы, синтезирующие белок, предназначенный для транспорта через мембрану, сами сидят на мембране (мембраносвязанные рибосомы), и растущий полипептид в развернутом виде поступает из них непосредственно в мембрану; 2) свободные (не прикрепленные к мембране) рибосомы цитоплазмы синтезируют полипептидную цепь, которая по мере выхода из рибосомы взаимодействует со специальными белками - молекулярными чаперонами . Чапероны препятствуют полному сворачиванию белка в компактную структуру и поддерживают его недосвернутое состояние в растворе. После освобождения из рибосомы эти недосвернутые белки взаимодействуют с мембраной и транспортируются через нее. Поддержание недосвернутого состояния белков чаперонами может требоваться также и для интеграции этих белков в надмолекулярные структуры клетки, для сборки четвертичных структур сложных белков, для вступления в комплексы с некоторыми лигандами и т.п. В этих случаях белки формируют свои пространственные структуры в составе указанных структур и комплексов. Об этом подробнее в следующем разделе.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.