Рис.. Позитивный и негативный контроль сплайсинга в экспрессии одинаковых генов разными клетками
На рис. показаны возможные варианты позитивного (2) и негативного (1) контроля сплайсинга в двух типах клеток. Молекула репрессора тормозит сплайсинг первичного транскрипта РНК в клетке 2, а молекула активатора включает механизм сплайсинга в той же клетке. Это позволяет создавать различные белки с первичных транскриптов одного и того же гена в разных клетках или переключать образование функционально активных и неактивных белков в пределах одной клетки.
Присоединение поли А к 3’ концу РНК может контролироваться клеткой.
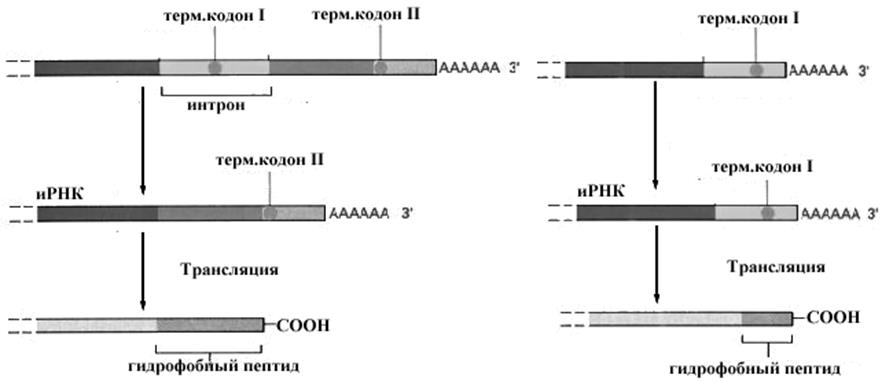 |
Рис.10-27.Схема регуляции синтеза мембраносвязанных и растворимых форм антител.
тов. Секретируемые молекулы антител идентичны мембраносвязанным за исключением строения С-концевого отдела молекулы, который у мембраносвязанных антител представлен длинным отрезком гидрофобных аминокислот, обеспечивающих встраивание этих молекул в мембрану. Это объясняется тем, что первичные транскрипты активированного и неактивированного антигеном лимфоцита различаются по длине. Короткий транскрипт активированного лимфоцита не содержит участка, кодирующего гидрофобные аминокислоты и образующиеся после трансляции белки не задерживаются в мембране, а секретируются из клетки.
Длина первичных транскриптов РНК примерно в 10 раз больше длины молекул иРНК в цитоплазме. Значительная часть последовательностей нуклеотидов разрушается в ядре. Основную массу этой разрушаемой РНК составляют интронные отделы транскриптов, удаляемые при сплайсинге, однако не исключается возможность, что часть разрушаемой РНК может иметь значение для одних клеток и не использоваться другими. Транспорт через ядерную мембрану – активный процесс и требует определенных знаков структуры на РНК. Молекулы иРНК не покидают ядро до тех пор, пока не произойдет сплайсинг интронов и этот механизм задержки РНК в ядре несомненно должен быть регулируем. иРНК попадающая в цитоплазму затем переносится в соответствующие отделы клетки, что определяется также определенными особенностями структуры 3’ конца молекулы, который не используется в трансляциииРНК.
Еще один механизм модификации РНК после ее попадания в цитоплазму это редактирование РНК. Процессы редактирования, т.е. изменения последовательности нуклеотидов в иРНК путем вставки, удаления или модификации оснований наблюдаются во многих случаях. Так, иРНК кодирующая белки митохондрий у трипаносом подвергается модификации в форме вставки одного или нескольких уридиловых нуклеотидов, что значительно изменяет «смысл» кодируемых белков. Активное редактирование иРНК обнаружено и у растений. При этом идет химическая замена Ц на У без вставки. Редактирование иРНК встречается и у млекопитающих. РНК, кодирующая аполипопротеин В в кишечнике подвергается редактированию путем дезаминирования Ц с образованием У, что вызывает образование терминирующего кодона в середине молекулы иРНК. При трансляции такой иРНК образуется укороченная копия аполипопротеина В –апо В-48. В печени эта иРНК не подвергается редактированию и клетки печени синтезируют полный апопротеин апоВ-100.
Все бактериальные иРНК довольно быстро разрушаются и синтезируются. Время их полураспада не превышает 3 минут. Это обеспечивает быстрое приспособление микроорганизмов к меняющимся условиям окружающей среды. иРНК эукариотических клеток более стабильны. Стабильность иРНК определяется особенностями структуры самих РНК. Молекулы иРНК модифицируют свои 3’ концы присоединением полиаденилового фрагмента. По мере участия иРНК в процессах трансляции, длина этого фрагмента уменьшается. Критическим для стабильности считается 30 адениловых нуклеотидов. В частности сигналами для быстрого разрушения молекул могут служить последовательности богатые У и А на 3’ концах этих РНК, которые являются сигналами для более быстрого удаления полиадениловых участков РНК. Стабильность РНК может усиливаться некоторыми гормонами стероидной природы, которые не только стимулируют образование новых молекул РНК, но и стабилизируют функционирующие. В ряде случаев стабильность РНК определяется скоростью трансляции и потребностью белков. Например, стабильность РНК, кодирующих гистоны,
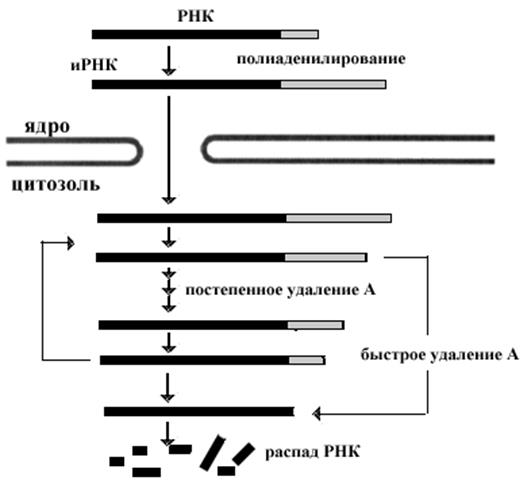 |
резко
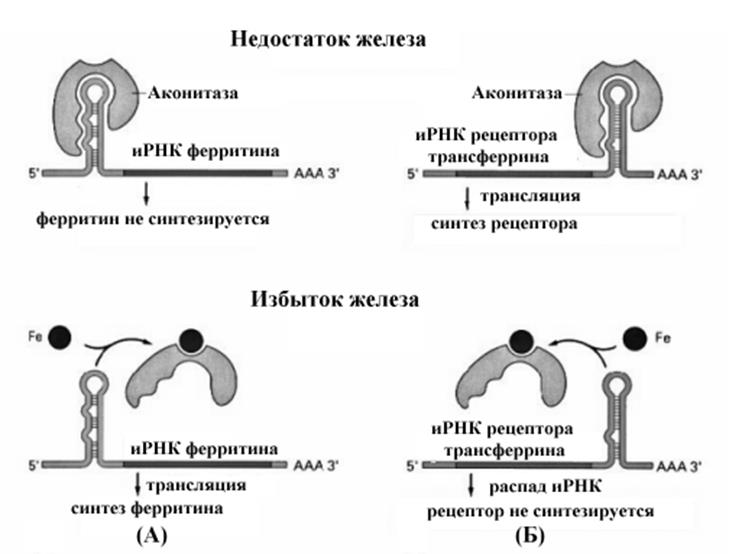 |
Рис..Влияние избытка и недостатка железа на синтез белков, участвующих в его обмене.
снижается, если замедляется синтез ДНК, с которой гистоны связываются. Этим поддерживаются определенные соотношения между двумя типами молекул.
Еще один пример регуляции продолжительности жизни РНК приводится на рис.10-29. В ответ на повышение поступления железа происходит усиление синтеза ферритина, связывающего и депонирующего железо в клетке и снижение синтеза рецептора трансферрина, что обеспечивает снижение поступления железа. Оба эффекта опосредованы одним и тем же чувствительным к железу белком аконитазой, которая участвует в двух разных механизмах.
Заключение: Таким образом регуляция экспрессии генетической информации может быть направлена и на процессы транспорта молекул белков в клетке, а также на процессы посттрансляционной модификации молекул и процессы их распада
доц. каф. биохимии Свергун В.Т.
дата
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.