![]()
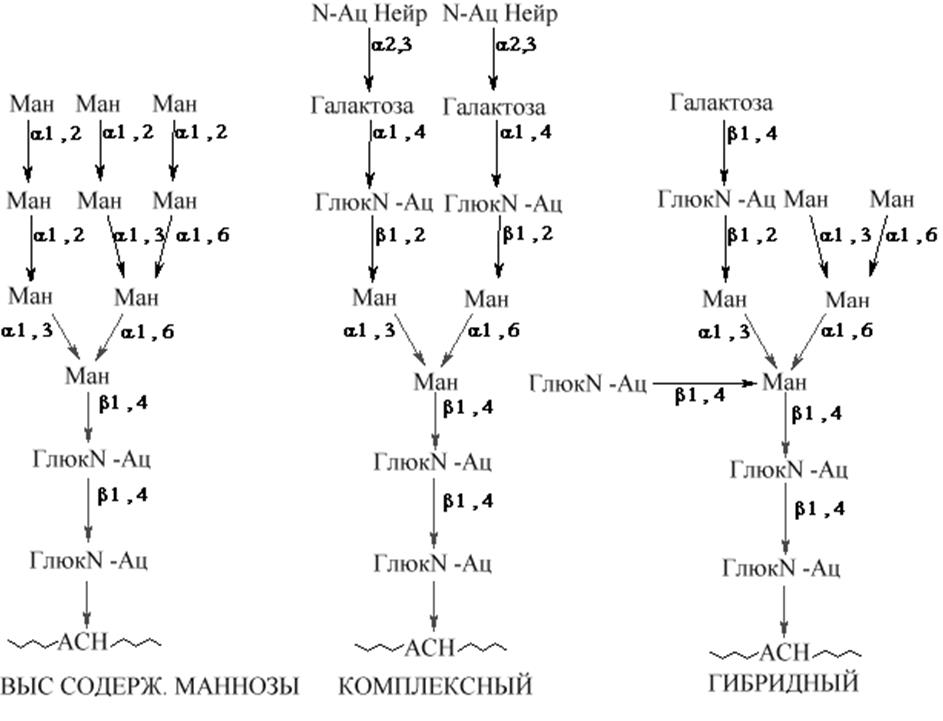 |
1. Семейство с высоким содержанием маннозы
2. Гибридный тип содержит кроме манозы другие гексозы и аминогексозы
3. Комплексныйподобен гибридному, но кроме гексоз и аминогексоз содержит различные количества производных нейраминовой кислоты, присоединенных к концевым отделам олигосахаридных частей молекул.
Углеводы в белке могут быть сигналами в клеточной сортировке белков. Ферменты, которые предназначены для лизосом (лизосомные ферменты) направляются после синтеза на рибосомах в лизомы специфичной модификацией углеводного компонента фермента. Лизосомные ферменты относятся к семейству N связанных гликопротеинов и имеют базовый олигосахарид, содержащий маннозу. Во время прохождения через аппарат Гольджи к С6 одной из манноз присоединяется остаток a-N-ацетилглюкозамин-1-фосфата (Глюк N-Ац - 1 - Ф) при участии Глюк N-Ац-фосфотрансферазы. Образуется фосфодиэирная связь (Глюк N-Ац - 1 - Ф -6-Манноза- Белок). Вторая реакция (катализируемая Глюк N-Ац -1-фосфодиэфир-N-ацетилглюкоминидазой) удаляет Глюк N-Ац, при этом остающийся остаток маннозы, связанной с белком фосфорилирован в 6 положении: Ман-6-Ф -Белок. В мембранах аппарата Гольджи имеется специфический рецептор к Ман- 6-Ф. Связывание Ман-6-Ф рецептором обеспечивает перенос ферментов в лизосомы.
Идентифицировано два различных рецептора к Ман- 6-Ф. Они являются интегральными мембранными белками. Один рецептор большой с молекулярной массой около 275 кДа, а другой рецептор с меньшей молекулярной массой (около 46 кДа). Большой рецептор связывает 2 молеклы Ман- 6-Ф, а меньший -1 молекулу на субъединицу. Больший рецептор не требует дивалентных катионов для связывания лиганда и назван катион независимым Ман-6-Ф рецептором (CI-MPR). У людей CI-MPR также связывает негликозилированный полипептидный гормон подобный инсулину фактор роста II (IGF -II) и поэтому называемый Ман-6-Ф/IGF-II рецептором. Участки, связывающие IGF –II и Ман-6-Ф, различаются друг от друга. Получены доказательства, что оба рецептора обеспечивают направление недавно синтезированных лизосомных ферментов к лизосомам.
Нарушение активности Глюк N-Ац-фосфотрансферазы, катализирующей присоединение Глюк N-Ац- 1-Ф к остаткам Ман (Глюк N-Ац-фосфотрансферазы) в лизосомных ферментах приводит к формированию плотных включений в фибробластах и нарушению правильного перемещения ферментов в лизосомы. Описаны два заболевания , связанные с нарушением транспорта лизосомных ферментов: I – клеточная болезнь (муколипидоз II) и полидистрофия (муколипидоз III), или муколипидоз -HI. I - Клеточная болезнь характеризуется тяжелыми психомоторными нарушениями , деформацией скелета, болезненной ограниченной подвижностью в суставах и ранней смертностью. В крови увеличивается активность ферментов лизосом. Муколипидоз III протекает менее тяжело; она прогрессирует более медленно, и больные доживают до взрослого состояния.
Антигены групп крови АВО - это углеводные половины гликолипидов на поверхности клеток или углеводные части гликопротеинов сыворотки. Углеводная часть поверхностных антигенов эритроцитов связана со сфинголипидами, формируя класс гликосфинголипидов. Те же углеводные компоненты в составе гликопротеинов сыворотки крови названы секреторными формами. Групповая принадлежность обеспечивается особенностями структуры углеводной части
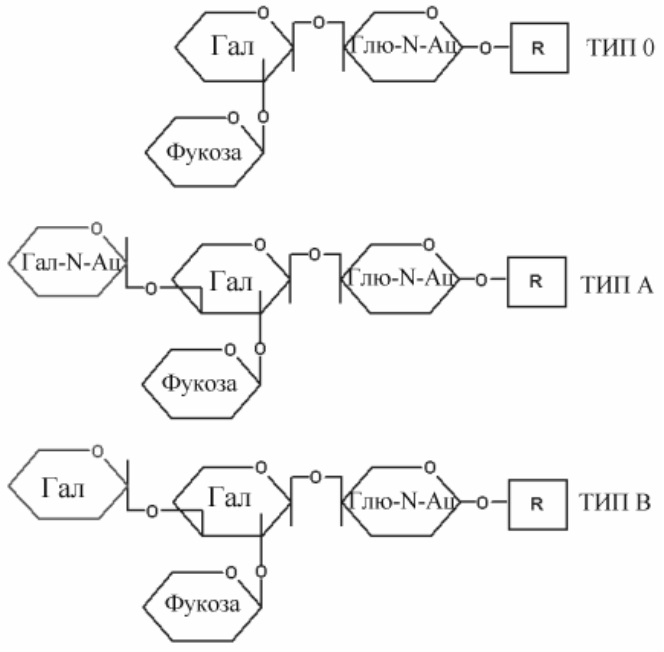
Рис.Структура углеводной части антигенов групп крови системы АВ0.
Углеводы могут присоединяться к белкам при участии липидов. Некоторые мембранные гликопротеины соединяются с мембраной при помощи липидов: белок соединяется с углеводом через фосфатидилэтаноламин, а углевод в свою очередь присоединяется к мембране через связь с фосфоатидилинозитолом. Последний выполняет роль мембранного якоря для всего гликолипопротеина. Связь называют гликозилфосфатидилинозитольгным (GPI) якорем. Один из белков, стабилизированый таким якорем к мембране эритроцитов DAF (decay-accelerating factor) – белок, предотвращающий лизис эритроцитов системой комплемента. Нарушение связи этого белка с мембраной отмечено при пароксизмальной ночной гемоглобинурии. Известны и другие белки использующие GPI якорь для проявления активности - ферменты АХЭ, кишечная и плацентарная щелочная фосфатаза и 5 ' нуклеотидаза, молекулы клеточной агезии N-CAM (neural Cell Adhesion Molecule) и T- Клеточные маркеры Thy1 и LFA-3 ((Lymphocyte Function associated Antigen-3).
.
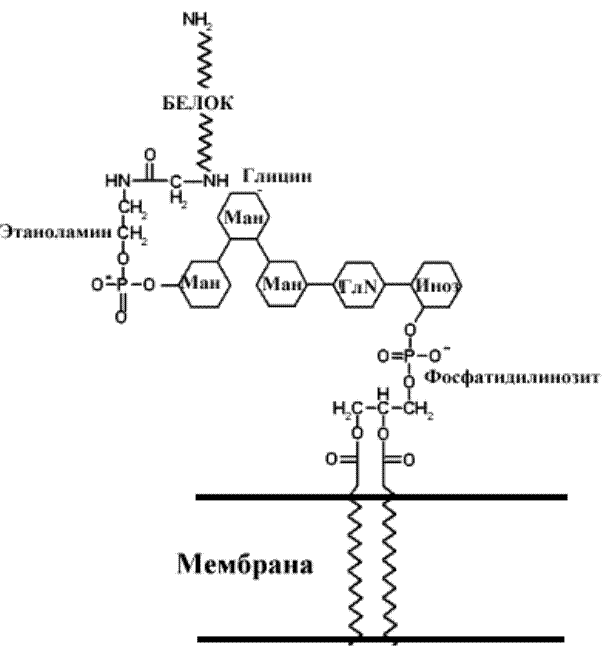
Рис.. Участие липидов в связывании углеводов и белков в белково-углеводных комплексах.
Некоторые вирусы бактерии и простейшие используют гликопротеины для проникновения в клетки. Возбудитель малярии Plasmodium vivax, связывается с эритроцитарным хемокиновым рецептором (рецептор интерлейкина-8) при проникновении в клетку. С той же целью риновирусы используют присоединение к молекуле, участвующей в межклеточной адгезии ICAM-1.MN система групп крови - хорошо характеризованный набор поверхностных антигенов эритроцитов, представляющие углеводные модификации трансмембранного гликопротеина гликофорина. Гликофорин - клеточный рецептор для вируса гриппа и рецептор для вторжения эритроцита малярийным паразитом Plasmodium falciparum. . Helicobacter pylori - бактерия, ответственная за хронический активный гастрит и язвенную болезнь желудка и двеннадцатиперстной кишки может быть причиной аденокарциномы желудка. Эта бактерия присоединяется к гликопротеину на поверхности слизистых клеток желудка (антиген группы крови системы Льюиса),.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.