ПОНЯТИЕ КЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
-
Клинические исследования - исследования, организованные для оценки различных вмешательств, при том, что их условия проведения направлены на устранение влияния систематических ошибок на результаты.
Этапы разработки новых лекарственных средств
1. Доклинические исследования:
- фармакологические исследования. Определяют основное действие нового ЛС, специфическую активность, длительность действия, влияние на анатомо-физиологические системы, побочные эффекты.
- фармакокинетические исследования.
- токсикологические исследования. Изучают острую токсичность при однократном введении; хроническую токсичность при повторном введении;специфическую токсичность и возможность вызывать лекарственную зависимость
2. Клинические исследования
Первичные клинические исследования
-
Эксперименты (experiments) - опыты на животных или добровольцах в искусственных и контролируемых условиях
-
2. Клинические испытания (clinical trial)- вмешательства на группе пациентов с последующим наблюдением
-
3. Клинические исследования (survey) - измерения чего-либо в определенных группах
Вторичные клинические исследования
1. Обзоры:
- несистематические, обобщающие результаты первичных исследований
- систематические -то же, но на основе жесткой методологии
- мета - анализы - обобщают качественные данные нескольких исследований
2. Клинические рекомендации, в них сформулированы выводы из первичных исследований, касающиеся требований к действиям врачей.
3. Экономический анализ
Цели клинических исследований
1. Оценка терапевтической или профилактической эффективности и переносимости нового препарата
2. Установление оптимальных доз и схем применения препарата
3. Сравнение с уже существующими препаратами
Дизайн клинического исследования
1. Сравнение параллельных групп
2. Парное сравнение
3. Сравнение результатов у одного и того же пациента
4. Одиночное слепое исследование
5. Двойное слепое исследование (исследование с двойным контролем)
6. Плацебо-контролируемое исследование
Фазы клинических исследований
-
Клинико-фармакологические исследования
-
Пилотные и контролируемые исследования
-
Расширенные исследования
-
Пострегистрационные исследования
Клинико-фармакологические исследования
-
Оценка однократного приема препарата. Служит для изучения фармакокинетических свойств и подтверждения безопасности ЛС у здоровых добровольцев, или специальной популяции больных. Контрольная группа отсутствует.
-
Цели первой фазы:
-
оценить переносимость исследуемого лекарственного средства;
-
установить наличие терапевтического действия;
-
создать рациональную основу для выбора доз и схем лечения
Пилотные и контролируемые исследования
-
Цель этой фазы – продемонстрировать предварительную информацию об идеальной эффективности препарата и о соотношении доза/эффективность, установить оптимальные режимы дозирования.
-
Цель пилотных исследований – поиск дополнительных фармакологических свойств ЛС у больных
-
Цели контролируемых исследований:
-
сравнение эффективности и переносимости с другими препаратами;
-
сравнение эффективности и переносимости различных доз ЛС;
-
сравнение качества жизни
Расширенные исследования
-
Цель исследования – получение дополнительных сведений об эффективности и побочных действиях ЛС.
-
Обоснованность рекомендаций по клиническому применению препарата:
-
эффективнее известных препаратов аналогичного действия;
-
обладает лучшей переносимостью при одинаковой эффективности;
-
эффективен при безуспешности лечения аналогичными препаратами;
-
более выгоден экономически; имеет более простую методику лечения или более удобную лекарственную форму;
-
эффективен при комбинированной терапии без увеличения токсичности
Пострегистрационные исследования
-
Цели:
-
изучение возможностей для расширения показаний к применению ЛС;
-
усовершенствование режимов назначения, схем лечения;
-
длительное наблюдение
Систематическая ошибка
-
Систематическая ошибка (смещение результатов) – любой фактор, который влияет на выводы и искажает сравнительную оценку.
-
Причины систематических ошибок
-
Отличие участников, включенных в КИ, по определенным характеристикам от лиц с той же патологией, но не включенных в исследование
-
Нерандомизированное распределение участников
-
Наличие искажающего (вмешивающегося) фактора
-
Отсутствие «ослепления»
-
Виды систематических ошибок
-
Обусловленные отбором – сравниваемые группы пациентов различаются по факторам, влияющим на исход
-
Вследствие оказания ухода – различия в проводимом уходе за пациентами, помимо оцениваемого вмешательства
-
Вследствие исключения – в результате «выпадения» пациентов из исследования
-
Различия в оценке исходов.
Классификация клинических исследований
1. Обсервационные КИ
- описательные
- аналитические
2. Экспериментальные КИ
Обсервационные КИ
1. Описательные исследования:
- описание случая (серии случаев)
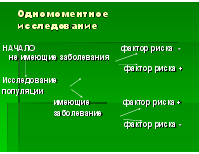
- одномоментные (поперечные) исследования
2. Аналитические исследования:
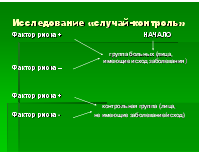
- случай - контроль
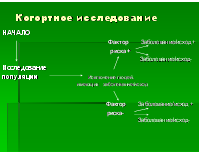
- когортные исследования
Описание случаев