В чистій воді [H+] = [OH-] = 10-7 моль/л. При додаванні кислоти збільшується концентрація [H+] і зменшується концентрація іонів [OH-], при додаванні лугу – навпаки.
На практиці для характеристики кислотності середовища використовують водневий показник рН = -lg [H+]. Так, в чистій воді [H+] = [OH-] =10-7; pH = 7; в кислому середовищі [H+] > [OH-], pH < 7; в лужному середовищі [H+] < [OH-], pH > 7.
Приклад 3. Вирахувати рН 0,05 %-го розчину NaOH, вважаючи, що
густина розчину і ступінь дисоціації NaOH дорівнюють одиниці.
Розв’язок.
1. m розч (NaOH) - ?
Вважаємо, що маємо 1л розчину лугу, його маса m(розч) = Vr =
= 1000мл . 1г/мл = 1000 г
2. m (NaOH) - ?
m (NaOH) = m(розч) . w(розч) = 1000 . 0,0005 = 0,5 г
3. См(NaOH) - ?
СNaOH = 0,05 :40 = 0,0125 моль/л.
4. [OH-] - ?
Ступінь дисоціації NaOH дорівнює одиниці, тому [OH-] = СNaOH, тобто [OH-] = 0,0125 моль/л.
5. [H+] - ?
[H+]= ![]() =
=
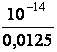 = 8·10-13 моль іон/л.
= 8·10-13 моль іон/л.
6. pH - ?
рН = - lg [H+] = - lg 8·10-13 = 12,1.
Відповідь: рН розчину дорівнює 12,1.
Питання і задачі
1. Що таке ступінь і константа дисоціації? Напишіть рівняння дисоціації таких сполук: H2SO3, Al(OH)3, K2SO4, Na3PO4, NH4H2PO4, Al(OH)2Cl.
2. Які електроліти належать до слабких і які до сильних?
3. Сформулюйте закон розбавлення Оствальда.
4. Що таке позирний ступінь дисоціації?
5. Запишіть рівняння, яке пов’язує ступінь дисоціації, та ізотонічний коефіцієнт.
6. Визначити осмотичний тиск 0,01 Н розчину MgCl2 при 18 °С, якщо позирний ступінь дисоціації цього електроліту дорівнює 66 %.
7. Що таке іонний добуток води і pH? Вирахувати pH 0,15 н. розчину ацетатної кислоти (Kд = 1,0.10-5), 0,15 н розчину HСl.
8. Визначити молярну концентрацію KOH, якщо pH розчину дорівнює 10.
9. Константа дисоціації HNO2 дорівнює 5,1.106. Визначити ступінь дисоціації її у 0,01М розчині і концентрацію іонів водню.
10. Визначити a і концентрацію іонів ОН- у 0,1 Н розчині NH4OH, якщо Кд = 1,77.10-5.
11. Ізотонічний коефіцієнт розчину 178,5 г KВr в 900 г H2O дорівнює 1,7. Визначити тиск водяної пари над цим розчином при 50 °С , якщо тиск пари води при 50 °С дорівнює 12334 Па.
Лабораторна робота № 8
До реакцій обміну в розчинах належать взаємодія між кислотами і основами, в результаті якої утворюється сіль і вода. Такі реакції називаються реакціями нейтралізації. Вони йдуть до кінця тільки тоді, коли реагують сильні основи і кислоти. Наприклад:
HCI + KOH ® KCl + H2O;
H+ + Cl- +K+ + OH- ® K+ + Cl- + H2O;
H+ + OH- ® H2O.
Скорочене іонне рівняння показує, що рівновага практично повністю зміщюється в сторону утворення води. Нейтралізація кислот і основ, різних по силі, до кінця не відбувається. Наприклад:
CH3COOH + KOH « CH3COOК + H2O;
CH3COOH + OH- « CH3COO- + H2O;
HCl + NH4OH « NH4Cl + H2O;
H + + NH4OH « NH4+ + H2O.
Ці реакції оборотні, тому що малодисоційовані сполуки утворюються в результаті прямої і зворотної реакцій.
Реакція, зворотна реакція нейтралізації, тобто взаємодія солі з водою з утворенням кислоти і основи, називається гідролізом солі.
Причиною гідролізу є участь У реакції слабкої основи і кислоти. При цьому катіон солі (відповідний слабкій основі) поляризує молекулу води і зв’язує гідроксильний іон. Визволений іон Н+ утворює кисле середовище (рН < 7). Навпаки, аніон солі, відповідний слабкій кислоті, зв’язує іон Н+ води і визволяє іон ОН- (рН > 7).
Розглянемо гідроліз різних солей.
1. Солі сильної кислоти і сильної основи гідролізу не підлягають, рН»7 (NaCl; Ba(NO3)2; K2SO4).
2. Солі сильної кислоти і слабкої основи гідролізуються зі збільшенням концентрації Н+:
NH4NO3 + H2O « NH4OH + HNO3;
NH4+ + H2O « NH4OH + H+; pH < 7.
3. Солі слабкої кислоти і сильної основи гідролізуються зі збільшенням концентрації ОН-:
KCN + H2O « KOH + HCN;
CN- + H2O « OH- + HCN; pH > 7.
4. Солі слабких кислот і основ гідролізуються і рН розчину залежить від їх відносної сили і взагалі близький до 7:
CH3COONH4 + H2O « NH4OH + CH3COOH;
CH3COO- + NH4+ + H2O « NH4OH + CH3COOH; pH » 7.
5.Гідроліз солей багатоосновних кислот або багатокислотних основ відбувається ступінчасто:
а) K3PO4 + H2O « K2HPO4 + KOH;
PO43- + H2O « HPO42- + OH-; pH > 7;
K2HPO4 + H2O « KH2PO4 + KOH;
HPO42- + H2O « H2PO4- + OH-; pH > 7,
гідроліз до кінця не проходить, тому що накопичення іонів ОН- заважає утворенню Н3РО4;
б) FeCl3 + H2O « FeOHCl2 + HCl;
Fe3+ + H2O « Fe (OH)2+ + H+; pH < 7
FeOHCl2 + H2O « Fe(OH)2Cl + HCl
Fe(OH)2+ + H2O « Fe(OH)2+ + H+; pH < 7,
накопичення іонів Н+ заважає утворенню Fe(OH)3 по третьому ступеню.
в) гідроліз солей дуже слабких основ і кислот (Al2S3, Cr2S3, Al2(CO3)3…) відбувається до кінця. В розчині такі солі не існують (в таблиці розчинності їх позначають знаком ¢¢-¢¢);
Cr2S3 + 6H2O = 2Cr(OH)3¯ + 3H2S; pH»7;
![]()
![]() Fe(CO3)3 + 6H2O = 2Fe(OH)3¯ + 3H2CO3;
pH»7;
Fe(CO3)3 + 6H2O = 2Fe(OH)3¯ + 3H2CO3;
pH»7;
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.