ХІМІЧНА КІНЕТИКА. ХІМІЧНА РІВНОВАГА.
Розділ хімії, який розглядає швидкості і механізми хімічних процесів, називається хімічною кінетикою. Швидкість хімічної реакції - число елементарних актів взаємодії за одиницю часу. Для гомогенних реакцій швидкість визначається як зміна концентрацій вихідних речовин або продуктів реакції за одиницю часу.
де Dc = c2 - c1 – зміна концентрації.
Вплив концентрації. Порядок і молекулярність реакції.
Залежність швидкості реакції від концентрації реагуючих речовин описується кінетичним рівнянням, яке визначається експериментально.
Для реакції aA + bB = Cc + dD; v = kCАnA CBnB , де СА і СВ - концентрації компонентів А і В; nA і nB – порядки реакції по компонентах А і В.
Порядком реакції по даному компоненту називається показник ступеня при концентрації цього компонента в кінетичному рівнянні- Загальний порядок реакції n дорівнює сумі порядків реакції по окремих компонентах: n = nA + nB; k – константа швидкості реакції, яка чисельно дорівнює швидкості реакції при концентрації реагуючих речовин чи їх добутку, що дорівнює 1; значення k не залежить від концентрацій реагуючих речовин і є сталим при сталій температурі.
Кінетичне рівняння залежить від
механізму реакції, тобто від того, через які стадії відбувається даний процес.
Якщо реакція відбувається в одну стадію, вона називається простою. Найчастіше
реакції є складними, тобто перетворення вихідних речовин у кінцеві проходить
через ряд елементарних стадій.
Для простих реакцій чи елементарних стадій справедливий закон діючих мас: при постійній температурі
швидкість хімічної реакції прямо пропорційна добутку концентрацій реагуючих
речовин у ступенях, що дорівнюють їх стехіометричним коефіцієнтам.
Наприклад, для реакції Н2 + І2 ®2НІ, яка є простою реакцією першого порядку по Н2 і І2, сумарний порядок дорівнює 2, кінетичне рівняння має вигляд v = k[H2][I2].
Для складних реакцій кінетичне рівняння не відповідає стехіометричному. Так, для реакції 2N2O5 = 4NO2 + O2 кінетичне рівняння таке: v = k[N2O5]. Реакція відбувається через стадії:
N2O5 = N2O3 + O2; (1)
N2O5 + N2O3 = 4NO2. (2)
Перша стадія, більш повільна, лімітує швидкість усієї реакції і визначає її перший порядок по N2O5.
Число молекул, які беруть участь в елементарному акті хімічного перетворення, називається молекулярністю. Так, перша стадія – мономолекулярна, друга - бімолекулярна. Для простих реакцій порядок і молекулярність співпадають, для складних - не співпадають.
Приклад 1. Визначити вид кінетичного рівняння для реакцій в газовій фазі:
A + B + 2D = F + L, якщо при збільшенні концентрації СА в 2, 3, 4 раза швидкість реакції v збільшилась в 2, 3, 4 раза, при такому ж збільшенні CB не змінилась, а CD – збільшилось в 4, 9, 16 раз. Як зміниться швидкість реакції при збільшенні тиску в 2 рази?
Розв’язок:
З умови задачі виходить, що v залежить прямопропорційно від CA, не залежить від CB і пропорційна квадрату CD, тобто v = kCA1CB0CD2. Отже, реакція першого порядку - по A, нульового - по B, другого - по D. Загальний порядок реакції дорівнює 1+ 0 + 2 = 3.
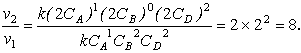 |
Відповідь: кінетичне рівняння має вигляд v = k CA1CB0CD2; швидкість реакції збільшується в 8 разів.
Вплив температури
![]()
В більшості випадків
швидкість реакції збільшується при підвищенні температури. Згідно з
правилом Вант-Гоффа, при збільшенні температури на 10 оС швидкість
реакції збільшується в 2 – 4 рази, тобто
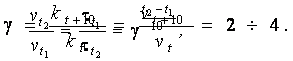 |
де γ - температурний коефіцієнт швидкості реакції, який показує, в скільки разів підвищується швидкість реакції при збільшенні температури на 10°.
Приклад 2. Визначити, в скільки разів збільшиться швидкість реакції при збільшенні температури на 40 оС, якщо температурний коефіцієнт швидкості цієї реакції дорівнює 3.
Розв’язок.
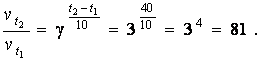 |
Відповідь: швидкість реакції збільшиться в 81 раз.
![]() де А - передекспоненціальний множник, який характеризує загальне число
співударів молекул, сприятливих в просторовому відношенні;
де А - передекспоненціальний множник, який характеризує загальне число
співударів молекул, сприятливих в просторовому відношенні;
Еа – енергія активації, Дж/моль – різниця
між енергією, необхідною для взаємодії і середньою енергією молекул; Т – абсолютна температура; R – універсальна газова стала; ![]() -- доля активних зіткнень.
-- доля активних зіткнень.
Збільшення швидкості реакції з підвищенням температури, пов’язане зі зростанням числа активних молекул.
Приклад 3. Розрахувати енергію активації реакції, якщо при температурі Т1 = 273 К константа рівноваги k дорівнює 4,04.10-5 c-1, а при T2 = 280 K k = 7,72.10-5 c-1.
Розв’язок:
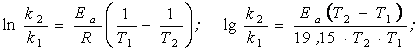 Використовуємо рівняння Арреніуса.
Використовуємо рівняння Арреніуса.
R = 8,3 Дж/(моль . К); lnA = 2,3. lgA;
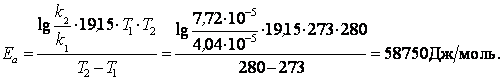 |
Відповідь: енергія активації дорівнює 58750 Дж/моль.
Збільшення швидкості хімічної реакції під впливом специфічних речовин, кількість яких не змінюється, називається каталізом.Речовини, які збільшують швидкість реакції, називаються каталізаторами, речовини, які уповільнюють реакції – інгібіторами.
Каталізатори беруть участь у реакції, але в результаті перетворень виділяються в числі продуктів у хімічно незмінному стані.
Процес при цьому відбувається іншим шляхом, який характеризується меншою енергією активації, що й пояснює збільшення швидкості реакції. Якщо реагенти, каталізатор і проміжні сполуки знаходяться в одній фазі, мова йде про гомогенний каталіз; якщо реагенти і каталізатор знаходяться в різних фазах, а перехідний стан утворюється на межі поділу фаз – про гетерогенний каталіз.
Хімічна рівновага
В основному хімічні реакції є оборотними, тобто можуть одночасно проходити в двох взаємно протилежних напрямках. Якщо швидкості прямої і зворотної реакції рівні, в системі встановлюється хімічна рівновага, яка при даній температурі характеризується константою рівноваги. Так, для реакції
аА + вВ « сС + dD
константа рівноваги виражається рівнянням:
Відповідно до закону діючих мас (ЗДМ) константа рівноваги будь-якої (простої чи складної) оборотної реакції – величина стала при сталій температурі. Вона може бути розрахована, якщо відомі вихідні концентрації речовин і рівноважна концентрація одного з реагентів.
Приклад 4. Для реакції A + 2B « L + 3M вихідні концентрації становлять: [A] = 2 моль/л; [B] = 3 моль/л, а рівноважна концентрація [L] = 0,5 моль/л. Визначити Кс (загальний об’єм залишається постійним).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.