Розв’язок:
З рівняння реакції видно, що 0,5 моля L отримується із 0,5 моля A і 1 моля B; при цьому утворюються 1,5 моля M. Тоді при рівновазі [A] = 2 – 0,5= 1,5 моль/л; [B] = 3 – 1 = 2моль/л; [L] = 0,5 моль/л; [M] = 1,5 моль/л.
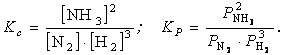 Константу рівноваги можна
виразити і через парціальний тиск. Так, для реакції N2(г.) +3H2(г.) « 2NH3 (г.)
Константу рівноваги можна
виразити і через парціальний тиск. Так, для реакції N2(г.) +3H2(г.) « 2NH3 (г.)
При цьому КP = KC(RT)Dn, де Δn - зміна числа газоподібних молекул в реакції.
Константа рівноваги пов’язана зі стандартною енергією Гіббса реакції
DG° = - RT. ln KР.
Це співвідношення дозволяє, якщо є енергія Гіббса реакції, розрахувати константу рівноваги і навпаки.
Принцип ле Шательє. Якщо на систему, яка знаходиться в рівновазі, подіяти зовнішнім фактором, то в ній виникають процеси, що зменшують цей вплив. Так, зміна температури змінює K: підвищення її зміщує рівновагу у бік ендотермічної реакції, зниження – у бік екзотермічної. Зміна тиску зміщує рівновагу газових реакцій при Δn ≠ 0: підвищення – в напрямку процесу, який супроводжується зменшенням числа молекул газів (об’єму), зниження – у бік збільшення числа молекул газів (об’єму).
Введення каталізаторів в рівноважну систему не може викликати зміщення рівноваги, тому що каталізатор прискорює і пряму, і зворотну реакції, прискорюючи процес досягнення рівноваги.
Питання і задачі
1. Що називається швидкістю хімічної реакції?
2. Як описується залежність швидкості реакції від концентрації реагуючих речовин для простих і складних реакцій?
3. Що таке порядок і молекулярність реакції? Коли вони тотожні?
4. Константа швидкості хімічної реакції.
5. Правило Вант-Гоффа. Рівняння Арреніуса. Чому швидкість реакції збільшується з підвищенням температури?
6. Що таке каталіз? Яка йього суть?
7. Що таке хімічна рівновага? Константа рівноваги, її зв’язок з енергією Гіббса.
8. Написати закон діючих мас для реакцїй:
2NO + O2 « 2NO2; N2 + 3H2 « 2NH3; H2CO3 « H2O + CO2.
9. Сформулювати принцип ле Шательє. Як збільшити вихід SO3 в реакції SO2 + O2 «2SO3; ΔH°реак = -179 κДж.
10. Визначити температурний коефіцієнт швидкості реакції розкладу мурашиної кислоти на СO2 і H2 в присутності золотого каталізатора, якщо константа швидкості при 413 K дорівнює 5,5.10-4 c-1, а при 458 K дорівнює 9,2.10-3 c-1.
11. Енергія активації реакції N2O5 ®N2O4 + 0,5O2 дорівнює 103,5 кДж/моль. Константа швидкості цієї реакції при 298 K дорівнює 2,0310-3 c-1 Вирахувати константу швидкості цієї реакції при 288 K.
12. Об’ємний склад реакційної суміші в момент рівноваги для реакції
2СО2(г.) « 2СО(г.) +О2(г.) був такий: 88,72 % CO2; 7,52 % CO; 3,76 % O2. Знайти KP і KC для цієї реакції, якщо загальний тиск в системі при температурі 273 К дорівнює 1,01133 .105 Па.
Лабораторна робота № 6
РОЗЧИНИ. ЗАКОНИ ІДЕАЛЬНИХ РОЗЧИНІВ.
Розчинами називають гомогеннi системи змiнного складу, якi знаходяться у станi хiмiчноϊ рiвноваги (ΔG = 0). Процес розчинення вiдбувається самодовiльно (ΔG<0).
Позначимо маси компонентiв gi г; ϊх суму ågi; кiлькiсть молей компонентiв ni ; їх суму åni ; молярнi маси Mi, г/моль; об’єм розчину V, л; еквiвалентну масу MЕi , г/моль.
1.Масова доляωi - вiдношення маси речовини до маси розчину . Якщо масова доля виражена в процентах, її називають масовими процентами, або процентною концентрацiєю:
Процентна концентрацiя чисельно дорiвнює кiлькостi грамiв речовини в 100 г розчину.
2.Мольна доляNi - вiдношення числа молей речовини до суми числа молей всiх компонентiв:
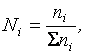 де
де 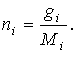
![]() 3.Молярна концентрацiя, або молярнiсть дорiвнює
числу молей розчиненоϊ речовини в 1 л розчину:
3.Молярна концентрацiя, або молярнiсть дорiвнює
числу молей розчиненоϊ речовини в 1 л розчину:
Розчини з молярнiстю 1 і 0,1… моль/л називаються одномолярними, децимолярними i т.п. Скорочено записують так: 1M розчин NaOH, 0,1M розчин HCl тощо.
4.Молярна концентрацiя еквiвалентiв (нормальнiсть) СNі – число еквiвалентiв речовини (nЕі = g / MЕі ) в одному лiтрi розчину
Згiдно з законом еквiвалентiв речовини реагують без залишку, якщо
CNIVI = CN2V2. Це вiдношення використовується в об’ємному аналiзi, тобто при визначеннi концентрацiї речовини вимiрюванням об’єму реагуючих речовин.
де g – маса розчинника,г; 1000 - коефіцієнт перерахунку г у кг.
Можна записати: ![]()
де r - густина розчину, г/мл, а w виражена у відсотках.
Приклад 1. Розрахувати титр, нормальнiсть, моляльнiсть, мольну долю i молярну концентрацiю 20%-ого розчину HСl (r = 1,1 г/мл).
Розв’язок.
1. Т(HCI) - ?
Т(HCI) = r Ч w = 0,20 Ч 1,1 = 0,22 (г/мл).
2.CN(HCI) - ?
а) T(HCI) = CN(НСІ) ЧMЕ(НСІ) / 1000, звiдси
CN(НСI) = Т(HCI).1000/MЕ(НСІ) = 0,22 Ч 1000/36,5 = 6,03 моль/л;
б) 1 л 20%-го розчину має масу 1000 Ч 1,1 = 1100 г, в ньому мiститься. 1100 . 20 / 100 = 220 г HClабо 220 / 36,5 = 6,03 еквiвалента HCl, тобто
CNHCl = 6,03 моль/л.
3. Сm(HCI) - ?
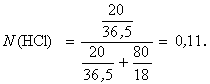 |
5.CM(HCI) - ?
![]()
![]()
Відповідь: Т(HCI) = 0,22 (г/мл), CN(HCI) = 6,03 моль/л; CM(HCI) = 6,03 моль/л; Сm(HCI) = 6,85 г/1000 г Н2О; N(HCI) = 0,11.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.