Приклад 2. Скiльки мiлiлiтрiв 12%-го розчину натрiй гідроксиду (r = 1,135 г/мл) потрiбно для приготування 210 мл 4,5%-го розчину NaOH (r = 1,05 г/мл)?
Розв’язок:
1. m (210 мл розчину NaOH) - ?
m = V . r = 210 мл . 1,05 г/мл = 220,5 г
2. m (NaOH) у 220,5 г розчину - ?
100 г розчину - 4,5 г NaOH;
220,5 г розчину - х г NaOH;
х = (220,5 Ч 4,5)/100 = 9,9 г NaOH.
3. m (12% розчину NaOH), необхiдна для приготування кінцевого розчину - ?
100 г 12%-го розчину – 12 г NaOH;
x г 12%-го розчину - 9,9 г NaOH;
x = (100 Ч 9,9)/12 = 82,8 г 12%-го розчину NaOH.
4.V (12%-го розчину NaOH), необхiдний для приготування кінцевого розчину - ?
V = m/r = 82,5 / 1,135 = 71,7 (мл.)
Відповідь: для приготування кінцевого розчину необхідно 71,7 мл вихідного розчину.
Закони iдеальних розчинiв.
Ідеальним називається розчин, в якому взаємодією між компонентами розчину можна нехтувати, при цьому DН = 0, DV = 0. До них наближуються розчини органічних речовин з близькими фізичними і хімічними властивостями (наприклад, розчин бензен-толуен) і дуже розбавлені розчини неелектролітів (наприклад, розчин цукру у воді).
При розчиненнi в леткому розчиннику нелеткої речовини поверхня випаровування зменшується, i тиск пари над таким розбавленим розчином буде тим меншим, чим бiльше концентрацiя нелеткого компонента. Кiлькiсно це можна виразити за допомогою тонометричного закону Рауля:
вiдносне зниження тиску насиченої пари розчинника над розчином дорiвнює мольнiй долi розчиненої речовини.
Де DР = Ро – Р – зниження тиску пари над розчином.
Приклад 3. Визначити тиск пари над розчином (Р), який містить 34,23 г цукру С12Н22О11 у 45,05 г води при 65 °С, якщо тиск пари води при цій температурі (з таблиці) дорівнює 2,5 .104 Па.
Розв’язок:
1. N (Н2О) - ?; N (С12Н22О11) - ?
М (Н2О) = 18 г/моль; М (С12Н22О11) = 342,3 г/моль;
N (Н2О) = 45,05/18 = 2,5 моля; N (С12Н22О11) = 34,23/342,3 = 0,1 моля.
2. Р (тиск пари води над розчином) - ?
Використовуючи тонометричний закон Рауля, визначимо Р:
Р = Р° -
Р°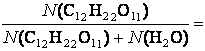 2,5.104 - 2,5.104.
2,5.104 - 2,5.104.![]() =2,5.104 - 0,96 .104 = 2,4 104
(Па).
=2,5.104 - 0,96 .104 = 2,4 104
(Па).
Відповідь: Тиск пари води над розчином цукру дорівнює 2,4 .104 Па.
В лінійній залежностi вiд тиску насиченої пари розчинника над розчином перебуває температура кипiння i замерзання розчину. Цю залежність виражає
ебулiоскопiчний i крiоскопiчний закони Рауля : збiльшення температури кипiння i зниження температури замерзання розчинiв пропорцiональнi їх концентрацiям. Dtкип = Keб . Сm; Dtзам = Ккр . Сm
де Keб i Kкр – вiдповiдно ебулiоскопiчна i крiоскопiчна константи, характернi для розчинника, Сm – моляльнiсть розчину.
Приклад 4.Визначити кріоскопічну константу води, якщо водний розчин етилового спирту (w = 11,3 %) замерзає при - 5°С.
Розв’язок:
1. Ккр (Н2О) - ?
Нехай маса розчину дорівнює 100 г. Тоді маса етилового спирту в ньому дорівнює 11,3 г (g), маса води - 88,7 г (G), молярна маса спирту М(С2Н5ОН) = 46,07 г/моль, Dtзам = 0 – (-5) = 5,0 °С.
Виходячи з кріоскопічного закону Рауля можна записати:
Ккр
= ![]() = 1,81 °С.
= 1,81 °С.
Відповідь: кріоскопічна константа води дорівнює 1,81 °С.
Приклад 5. Розчин камфори масою 0,552 г у етері масою 17 г закипає при температурі на 0,461° вище, ніж чистий етер. Ебуліоскопічна константа етеру Кеб = 2,16°С. Визначити молярну масу камфори.
Розв’язок:
Використаємо ебуліоскопічний закон Рауля.
Dt = Кеб Сm = ![]() ,
,
де g i G –маси камфори та етера відповідно, М - молярна маса камфори; звідки
М =  г/моль.
г/моль.
Відповідь: молярна маса камфори дорівнює 155,14 г/моль.
Розчини характеризуються також осмотичним тиском Росм, який спостерiгається на межi двох розчинiв з рiзною концентрацiєю, роздiлених напiвпроникною перегородкою. Росм обумовлений прагненням розчинника зрiвняти концентрацiю по обидвi сторони перегородки.
За законом Вант-Гоффа, Pосм = CМRT, де СМ – молярна концентрацiя; R – унiверсальна газова стала; Т – температура.
Приклад 6. Розчин, у 100 мл якого міститься 2,3 г речовини при 298 К, має осмотичний тиск 618,5 кПа. Визначити молярну масу речовини.
Розв’язок:
1. См (речовини) - ?
Згідно з законом Вант-Гоффа, запишемо: Росм = СмRT,
звідки См = Росм/RT = 618,5 . 103 / (8,3 .298) = 250 моль/м3 = 0,25 моль/л.
.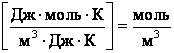
2. М (речовини)-?
Складемо пропорції:
100 мл - 2,3 г
1000 мл – х г, х = 23 г; 23 г - 0,25 моля
х1 - 1 моль х1 = 92 г/моль.
Відповідь: молярна маса речовини дорівнює 92 г/моль.
Питання i задачi.
1. Що називається розчином? Назвати iснуючi методи вираження їх концентрацiї.
2. Якi методи вираження концентрацiї слід вибирати, щоб вона не змiнювалась iз змiною температури?
3. Які розчини називаються iдеальними? Сформулюйте закони iдеальних розчинiв.
4. Який фiзичний змiст ебулiоскопiчної i крiоскопiчної констант?
5. Визначити процентний склад 2н розчину Сa(OH)2 (r = 1,09 г/мл).
6. До 345 мл 17 % розчину NaOH (r = 1,1 г/мл) додали 500 мл води. Одержали розчин густиною 1,04 г/мл. Визначити його молярнiсть, нормальнiсть, титр i процентний склад.
7. Скiльки мiлiлiтрiв 0,2М розчину Н2SO4 необхiдно для нейтралiзацiї 800мл 0,1М розчину NaOH?
8. Тиск пари води при 50 °С дорівнює 12334 Па. Визначити тиск пари води над розчином, який містить 50 г етиленгліколю С2Н4(ОН)2 у 900 г води.
9. При якій температурі буде замерзати водний розчин етилового спирту, якщо масова доля його у розчині складає 25 %?
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.