ОСl- + Н2О+2е-=2OH- +Cl-, (29)
С12 + 2е-= 2С1-. (30)
Поэтому по реакции:
CN- + OCl-® CNO- + Cl-, (31)
на одну часть циана, молекулярная масса которого равна 26, требуется одна часть кислорода или две части хлора, молекулярная масса которых равна 71. Отсюда, если на 26 частей циана требуется 71 часть «активного хлора», то на одну часть циана соответственно его необходимо 71 : 26 = 2,73. Этот коэффициент показывает нужное по реакции количество «активного хлора» для окисления единицы простого растворимого ядовитого цианида. Следовательно, если подвергаемая очистке сточная вода содержит А мг/л простых ядовитых растворимых цианидов, то теоретически необходимое количество «активного хлора» будет равно:
X = 2,73× А. (32)
Аналогично по реакции:
2[Cu(CN)3]2- + 7OCl- + 2OH- + H2O ® 6CNO- + 7Cl- + 2Cu(OH)2¯, (33)
для окисления комплексных цианидов меди на 6 частей циана требуется 7 частей кислорода или соответственно 14 частей хлора. Отсюда на 26×6 частей циана надо 71×7 частей «активного хлора» или на одну часть циана нужно 71×7/ 26×7 = 3,18 частей «активного хлора». Если очищаемая сточная вода содержит В мг/л комплексных цианидов меди в пересчете на CN-, то теоретически необходимое количество «активного хлора» составит:
Х = 3,18×В. (34)
Проведя подобный подсчет по реакции:
[Zn(CN)4]2 - + 4OCl- +2OH- ® 4CNO- + 4Cl- + Zn(OH)2¯ , (35)
найдем, что для окисления единицы комплексных цианидов цинка (в пересчете на CN) потребуется теоретически 2,73 части «активного хлора».
При обработке сточных вод предприятий цветной металлургии, содержащих сумму простых ядовитых растворимых цианидов и комплексных растворимых цианидов меди и цинка, теоретический расход «активного хлора» составит:
ХCl = 2,73 ×(А + С) + 3,18×В, (36)
где: А - концентрация простых растворимых ядовитых цианидов;
В - концентрация комплексных цианидов меди в пересчете на циан;
С - концентрация комплексных цианидов цинка в пересчете на циан.
Ввиду того, что товарная хлорная известь может содержать до 33% «активного хлора» (класс А), а гипохлорит кальция — до 60% «активного хлора» и т. д., подсчитать необходимое количество товарного реагента можно по формуле:
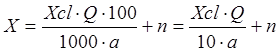 ,
(38)
,
(38)
где: X- количество товарного реагента (хлорной извести или гипохлорита), кг/сутки;
ХCl - количество «активного хлора», необходимое для окисления цианидов и подсчитанное по приведенным выше формулам, мг/л или г/м3;
Q- расход циансодержащих сточных вод, м3/сутки;
а - содержание «активного хлора» в товарном реагенте, %;
n - коэффициент избытка реагента, равный 3—5 мг/л [16].
1.2.2 Железосульфатный метод обезвреживания циансодержащих стоков
Он используется в некоторых производствах для обезвреживания концентрированных растворов цианидов с последующей доочисткой [32], [12]. Концентрация цианидов должна быть более 1г/л и не превышать 100 г/л [16], [39], [40]. Метод основан на переводе токсичных ионов циана в нетоксичные комплексные ионы [Fe(CN)6]4- или Fe(CN)2 в слабощелочной среде.
При рН=7 и без подогрева образуется значительное количество токсичного осадка простого цианида железа:
2NaCN + FeSO4®Fe(CN)2¯ + Na2SO4. (39)
При дополнительном введении в обрабатываемый сток FeSO4 цианид железа взаимодействует с непрореагировавшими цианидами с образованием нетоксичной берлинской лазури:
2Fe(CN)2 + 2NaCN+ FeSO4®Fe2[Fe(CN)6] + Na2SO4. (40)
При наличии в стоке комплексных цианидов меди их окисление протекает по схеме:
Na2[Cu(CN)3] + FeSO4 + Ca(OH)2 ®CuCN+Fe(CN)2¯+ Na2SO4. (41)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.