Если время оседлого нахождения атома в положении равновесия t представить в виде вероятностного закона:
![]() , где t0 – период
колебания атома в положении равновесия; Ua – энергия активации, равная сумме энергий образования
вакансии и преодоления энергетического барьера; k –
константа Больцмана; Т – температура; то коэффициент диффузии
представляется в виде скорости перемещения атома на фиксированное расстояние
"d", как расстояние перескока
атома:
, где t0 – период
колебания атома в положении равновесия; Ua – энергия активации, равная сумме энергий образования
вакансии и преодоления энергетического барьера; k –
константа Больцмана; Т – температура; то коэффициент диффузии
представляется в виде скорости перемещения атома на фиксированное расстояние
"d", как расстояние перескока
атома:
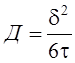 .
.
Цифра "6" в знаменателе означает перемещение атома направлении плюс и минус трехкоординатной декартовой системы.
После подстановки величины "t" выражение коэффициента диффузии принимает вид:
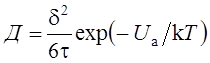 .
.
Часто энергию активации относят к одному молю вещества Ua = Qм и тогда k = R – газовая постоянная.
Тогда выражение коэффициента диффузии упростится:
![]() , где
, где 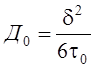 .
.
Для практического расчета коэффициента диффузии необходимо знание
энергии активации: Qм(Ua). Согласно активационной модели диффузии
энергия активации Qм должна быть
близка молярной теплоте испарения: ![]() . Другими словами
энергия перескока атома как бы приравнивается к энергии перехода атома из
конденсированной фазы в газовую (паровую). Однако сопоставление расчетных
данных коэффициента диффузии по вышеприведенной методике с экспериментальными
показывает, что величина Qм для
большинства металлов в 5-8 раз меньше молярной теплоты испарения. А,
следовательно, на эту величину должна быть сделана поправка при выборе величины
энергии активации. Отмеченное выше соотношение между теплотой испарения и
энергий активации для перескока атома свидетельствует, что для перескока атома
из одного положения узла решетки в другое энергия в 5-8 раз меньше, чем для
выхода атома из конденсированной фазы в паровую.
. Другими словами
энергия перескока атома как бы приравнивается к энергии перехода атома из
конденсированной фазы в газовую (паровую). Однако сопоставление расчетных
данных коэффициента диффузии по вышеприведенной методике с экспериментальными
показывает, что величина Qм для
большинства металлов в 5-8 раз меньше молярной теплоты испарения. А,
следовательно, на эту величину должна быть сделана поправка при выборе величины
энергии активации. Отмеченное выше соотношение между теплотой испарения и
энергий активации для перескока атома свидетельствует, что для перескока атома
из одного положения узла решетки в другое энергия в 5-8 раз меньше, чем для
выхода атома из конденсированной фазы в паровую.
Таблица 6
Коэффициенты диффузии некоторых металлов в расплавах
|
Диффундирующее вещество |
Диффузионная среда |
Температура °С |
Коэффициент диффузии Д×10-9 м2/с |
|
магний |
алюминий |
700 |
7,5 |
|
кремний |
железо |
1480 |
2,4 |
|
золото |
свинец |
500 |
3,7 |
|
серебро |
олово |
500 |
4,8 |
|
углекислый газ |
вода |
20 |
1,4 |
|
цинк |
медь |
1100 |
5,0 |
|
цинк |
медь (твердое состояние) |
1000 |
4,0×10-12 м2/с |
В табл. 6 представлены экспериментальные величины коэффициентов диффузии некоторых металлов в расплавах других металлов (для сравнения выделен коэффициент диффузии двуокиси углерода в воде). В нижней части таблицы для сравнения приведено значение коэффициента диффузии цинка в жидкой меди при температуре 1100°С, а в твердой меди при температуре 1000°С. Разница в значениях коэффициентов диффузии в жидкой и твердой меди приближается к трем порядкам. Такая большая разница в значениях коэффициентов диффузии не может быть объяснена ни действием температуры, поскольку разница в температурах 1000°С и 1100°С невелика, ни различиями в величине энергии активации – эта величина в соответствии с вышеприведенным анализом может различаться не более чем в несколько раз, но не на три порядка.
Наиболее достоверное объяснение разницы коэффициентов диффузии представляется таким, что в расплавах происходит перемещение не отдельных атомов, а целых групп атомов в виде кластеров или ячеек. Коллективное перемещение атомов может представляться в виде дрейфа группы атомов в поле тепловых гидродинамических флуктуаций, и коэффициент диффузии представляется в виде суммы неравных величин коэффициентов диффузии:
![]() , где Динд – коэффициент диффузии отдельных атомов;
Дкол – коэффициент диффузии группы (коллектива) атомов.
, где Динд – коэффициент диффузии отдельных атомов;
Дкол – коэффициент диффузии группы (коллектива) атомов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.