![]() г/м3 = 0,01 кг/м3.
г/м3 = 0,01 кг/м3.
2. Теоретический объем сухого воздуха для горения определяется по выражению (3.4):
![]() (2
(2![]() 97 + 3,5
97 + 3,5![]() 2 + 5
2 + 5![]() 0,3 +
6,5
0,3 +
6,5![]() 0,2) =9,7 м3/м3
газа.
0,2) =9,7 м3/м3
газа.
3. Теоретический объем влажного воздуха для горения по выражению (3.5) составит
![]() м3/м3 газа.
м3/м3 газа.
4. Окончательно для известного коэффициента избытка воздуха по выражению (3.7) определяем действительный объем влажного воздуха для полного сжигания газа:
![]() м3/м3 газа.
м3/м3 газа.
5. С целью сравнения методов расчета определим объем
воздуха для горения по приближенному выражению (3.6),
учитывая, что теплота сгорания топлива, определенная в прим. 2.1, составляет ![]() МДж/м3:
МДж/м3:
![]() м3/м3 газа.
м3/м3 газа.
Как видим, приближенная формула дает результат, весьма близкий к значению, полученному по более точному методу.
**********************************************************
3.3. Объем продуктов сгорания
Теоретические объемы продуктов, образующихся при горении различных газов в сухом воздухе, в соответствии с выражениями (3.1)—(3.3), приведены в табл. 3.1. Действительный объем продуктов сгорания углеводородных газов, м3/м3 газа, во влажном воздухе,подаваемом с необходимым избытком, можно определить по формулам (3.8)—(3.14), подставляя содержание соответствующих компонентов, % по объему.
1. Диоксид углерода
![]()
![]() . (3.8)
. (3.8)
2. Водяной пар
![]()
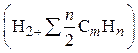 + 1,24
+ 1,24![]() , (3.9)
, (3.9)
где dг — абсолютная влажность газа, кг/м3.
3. Азот
![]() N2 + 0,79
N2 + 0,79![]() .
(3.10)
.
(3.10)
4. Кислород
![]() O2 + 0,21
O2 + 0,21![]() .
(3.11)
.
(3.11)
5. Суммарный объем влажных продуктов сгорания ![]() , м3/м3 газа:
, м3/м3 газа:
![]() =
= ![]() +
+ ![]() +
+ ![]() +
+ ![]() .
(3.12)
.
(3.12)
6. Суммарный объем сухих продуктов сгорания ![]() , м3/м3 газа, после конденсации
водяных паров, являющихся продуктом горения:
, м3/м3 газа, после конденсации
водяных паров, являющихся продуктом горения:
![]() =
= ![]() +
+ ![]() +
+ ![]() . (3.13)
. (3.13)
7. Теоретический
объем сухих продуктов сгорания ![]() , м3/м3 газа, (в
стехиометрических условиях) получаем по выражению (3.13), подставляя
в формулы (3.10) и (3.11) значение
, м3/м3 газа, (в
стехиометрических условиях) получаем по выражению (3.13), подставляя
в формулы (3.10) и (3.11) значение ![]()
![]() =
= ![]() +
+ ![]() +
+ ![]() . (3.14)
. (3.14)
**********************************************************
Пример3.2
Определить объем сухих и влажных продуктов сгорания природного газа. Состав газа и условия сжигания приведены в прим. 2.1 и 3.1.
Решение
1. Объем диоксида углерода определяем по формуле (3.8):
![]() (0,2 + 97 +2
(0,2 + 97 +2![]() 2 + 3
2 + 3![]() 0,3 + 4
0,3 + 4![]() 0,2)=1,03
м3/м3 газа.
0,2)=1,03
м3/м3 газа.
2. Объем водяных паров определяем по формуле (3.9):
![]() (2
(2![]() 97 + 3
97 + 3![]() 2 + 4
2 + 4![]() 0,3 + 5
0,3 + 5![]() 0,2)+1,24
0,2)+1,24![]() 1,1
1,1![]() 0,01
0,01![]() 9,7=2,15
м3/м3 газа.
9,7=2,15
м3/м3 газа.
3. Объем азота определяем по формуле (3.10):
![]()
![]() 0,3 + 0,79
0,3 + 0,79![]() 1,1
1,1![]() 9,7 =
8,4 м3/м3 газа.
9,7 =
8,4 м3/м3 газа.
4. Объем кислорода определяем по формуле (3.11):
![]() 0,21
0,21![]() м3/м3 газа.
м3/м3 газа.
5. Объем сухих продуктов сгорания по выражению (3.13) составит
![]() м3/м3 газа.
м3/м3 газа.
6. Объем влажных продуктов сгорания по выражению (3.12) составит
![]() м3/м3 газа.
м3/м3 газа.
4. Характеристики горения
4.1. Температура горения
В теплотехнике различают следующие температурные характеристики горения газов: жаропроизводительность, калориметрическую температуру, теоретическую температуру и действительную температуру горения. Эти характеристики имеют различное применение в зависимости от решаемых задач из области сжигания газообразных топлив.
4.1.1. Жаропроизводительность
(максимальнаятемпературагорения)
Жаропроизводительность, известная также как максимальная температура
горения ![]() ,
, ![]() , — понятие, предложенное Д.И. Менделеевым. Это температура продуктов полного сгорания топлива в
адиабатических условиях при
, — понятие, предложенное Д.И. Менделеевым. Это температура продуктов полного сгорания топлива в
адиабатических условиях при ![]() = 1,0 и при
температурах топлива и воздуха перед горением, равных 0
= 1,0 и при
температурах топлива и воздуха перед горением, равных 0 ![]() . Если объемы отдельных компонентов продуктов сгорания
обозначить через Vi, м3/м3 газа, а их средние
объемные теплоемкости (в интервале температуры от 0 до
. Если объемы отдельных компонентов продуктов сгорания
обозначить через Vi, м3/м3 газа, а их средние
объемные теплоемкости (в интервале температуры от 0 до ![]() ,
, ![]() ) — через
) — через ![]() , кДж/(м3
, кДж/(м3![]() K), то жаропроизводительность можно
определить по выражению
K), то жаропроизводительность можно
определить по выражению
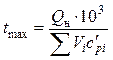 . (4.1)
. (4.1)
Таким образом, жаропроизводительность является теоретическим
понятием и определяется аналитически на основании расчетов объемов продуктов
сгорания, полученных при помощи выражений (3.8)—(3.10). При этом необходимо использовать
метод последовательных приближений, поскольку температура влияет на величину
средней теплоемкости. Сначала определяют объемы продуктов сгорания при ![]() = 1,0.
Задаваясь значением
= 1,0.
Задаваясь значением ![]() ,
рассчитывают их теплоемкости и по формуле (4.1) определяют жаропроизводительность.
Цикл расчетов повторяется при полученном значении
,
рассчитывают их теплоемкости и по формуле (4.1) определяют жаропроизводительность.
Цикл расчетов повторяется при полученном значении ![]() до удовлетворительного совпадения результатов.
до удовлетворительного совпадения результатов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.