2.1. Стехиометрические уравнения
Горением называется быстро протекающая химическая реакция взаимодействия горючих компонентов топлива с кислородом, которой сопутствует интенсивное выделение теплоты, вызывающее резкий рост температуры. В отличие от обычных химических реакций с высоким экзотермическим эффектом при горении наблюдается пламя, представляющее собой зону реакций, происходящих в газообразной фазе.
Теоретический итог реакций горения описывается при помощи так называемых стехиометрический уравнений. Эти уравнения качественно и количественно характеризуют вещества, вступающие в реакцию, и продукты, образующиеся в результате нее. В случае реакций горения их результат дополняется тепловым эффектом, то есть количеством теплоты, выделяющимся во время реакции. Рассмотрим примеры стехиометрических уравнений реакций горения водорода, оксида углерода и метана (без учета теплоты конденсации образующегося водяного пара):
![]() кДж,
(2.1)
кДж,
(2.1)
![]() кДж, (2.2)
кДж, (2.2)
![]() кДж.
(2.3)
кДж.
(2.3)
Реакция горения любого углеводорода может быть выражена универсальным уравнением
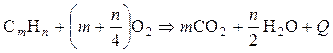 ,
(2.4)
,
(2.4)
где m — количество атомов углерода в молекуле углеводорода; n — количество атомов водорода в молекуле углеводорода; Q — тепловой эффект реакции (теплота сгорания).
Для распространенных компонентов горючих газов стехиометрические уравнения и тепловой эффект их реакции с кислородом приведены в табл. 2.1.
|
Наименование газов |
Стехиометрическое уравнение горения |
Теплота сгорания |
|
|
Qв, МДж/м3 |
Qн, МДж/м3 |
||
|
Водород |
H2+0,5O2 |
10,785 |
10,785 |
|
Оксид углерода |
CO+0,5O2 |
12,627 |
12,627 |
|
Метан |
CH4+2O2 |
39,758 |
35,831 |
|
Этан |
C2H6+3,5O2 |
69,668 |
63,765 |
|
Пропан |
C3H8+5O2 |
99,143 |
91,272 |
|
Бутан |
C4H10+6,5O2 |
128,493 |
118,675 |
|
Пентан |
C5H12+8O2 |
157,905 |
146,287 |
|
Этен |
C2H4+3O2 |
63,011 |
59,076 |
|
Пропен |
C3H6+4,5O2 |
91,942 |
86,039 |
|
Бутен |
C4H8+6O2 |
121,417 |
113,546 |
|
Пентен |
C5H10+7,5O2 |
150,725 |
140,928 |
|
Ацетилен |
C2H2+2,5O2 |
58,008 |
56,044 |
Необходимо подчеркнуть, что стехиометрические уравнения представляют только конечный результат горения и его суммарный тепловой эффект, однако по этим уравнениям нельзя судить ни о скорости протекания реакции, ни о механизме химических превращений.
2.2. Кинетика реакции горения
Скорость химической реакции W, моль/(м3![]() с),
можно определить как изменение концентрации компонентов за единицу времени в
единице объема. Для необратимых реакций, происходящих при сжигании горючих
газов, скорость их протекания можно описать следующей зависимостью:
с),
можно определить как изменение концентрации компонентов за единицу времени в
единице объема. Для необратимых реакций, происходящих при сжигании горючих
газов, скорость их протекания можно описать следующей зависимостью:
![]() ,
(2.5)
,
(2.5)
где k — константа скорости химической реакции; C1, C2 — концентрация реагирующих компонентов, моль/м3 (знак «–» в дифференциальной форме указывает на уменьшение концентрации исходных реагентов с течением времени).
При организованном сжигании топлива в технических устройствах концентрации реагирующих веществ можно условно считать постоянными, поскольку в зону горения происходит непрерывный приток топлива и окислителя. В этих условиях значение константы скорости реакции определяется экспоненциальным уравнением Аррениуса:
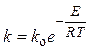 ,
(2.6)
,
(2.6)
где ko — предэкспоненциальный множитель, который характеризует данную реакцию и в первом приближении принимается постоянным; E — энергия активации, Дж/моль; R — универсальная газовая постоянная, Дж/(моль×K); T — абсолютная температура в реакционной зоне, K.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.