Уравнение (2.6) показывает, что скорость химической реакции зависит как от свойств реагентов (R, E), так и от температуры, быстро увеличиваясь с ее ростом.
2.3. Цепной механизм процесса горения
Быстрое протекание реакций горения вызвано не только ускоряющим действием температуры, но и цепным механизмом этих реакций. Как известно, любая химическая реакция связана с перегруппировкой химических связей между атомами при переходе реагентов из начального состояния в конечное. Такая перегруппировка требует, чтобы реагирующие вещества обладали значительным количеством избыточной энергии (энергией активации), необходимой для разрыва существующих внутримолекулярных связей. Однако преобразование исходных реагентов в конечные продукты реакции происходит не одностадийно, а в несколько этапов, с образованием и распадом промежуточных химически активных частиц: атомов и радикалов, генерируемых самой реакцией.
Эти частицы легко реагируют с исходными реагентами, а также между собой, приводя к образованию как конечных продуктов, так и новых радикалов, способных повторить такую же цепь реакций или инициировать новую. Нарастающее самопроизвольное генерирование активных частиц приводит к «разгону» химической реакции, воспринимаемому как взрыв всей реагирующей смеси.
Рассмотрим цепной механизм взаимодействия водорода с кислородом, как один из наиболее простых и изученных. Зарождение цепи при этой реакции связано с образованием атомарного водорода в результате диссоциации водорода молекулярного:
![]() (2.7)
(2.7)
Элемент M следует понимать как источник энергии активации. Это может быть открытое пламя, раскаленное тело, электрическая или механическая искра и т.п. Отметим, что аналогичное зарождение цепи реакции через атомарный кислород маловероятно, учитывая очень высокую энергию диссоциации молекулярного кислорода. Схема дальнейшего развития цепной реакции приведена на рис. 2.1.

Итогом такого единичного цикла является реакция
![]() . (2.8)
. (2.8)
Таким образом, каждый водородный радикал приводит к образованию двух частиц конечного продукта реакции в виде молекул воды и трех новых радикалов. В принципе каждый радикал может привести к развитию цепи в результате благоприятного соударения с молекулой кислорода, однако таким же вероятным является неблагоприятное столкновение двух радикалов, приводящее к образованию стабильной молекулы водорода:
![]() .
(2.9)
.
(2.9)
Свойством любого газообразного топлива является то, что в соответствующим образом приготовленной смеси с воздухом (окислителем) количество благоприятных столкновений, содействующих развитию цепи реакции, превышает количество неблагоприятных соударений, которые замыкают цепь. Поэтому воспламенение гомогенной газовоздушной смеси в любой точке приводит к быстрому распространению пламени на весь объем смеси, называемому взрывом.
Механизм реакции оксида углерода с кислородом похож на
описанный выше, однако он более сложен вследствие попутно развивающихся
реакций. Сухая смесь оксида углерода с кислородом вообще не реагирует до температуры
700 ![]() . При более высокой температуре протекает
медленная гетерогенная реакция. Распространение реакции на весь объем смеси
происходит только при наличии в смеси некоторого количества водяного пара или
атомарного водорода. Поэтому, как и в случае горения водорода, зарождение цепи
начинается от столкновения образовавшегося при диссоциации атома водорода со
стабильной молекулой кислорода:
. При более высокой температуре протекает
медленная гетерогенная реакция. Распространение реакции на весь объем смеси
происходит только при наличии в смеси некоторого количества водяного пара или
атомарного водорода. Поэтому, как и в случае горения водорода, зарождение цепи
начинается от столкновения образовавшегося при диссоциации атома водорода со
стабильной молекулой кислорода:
![]() .
(2.9)
.
(2.9)
Это означает образование сразу двух радикалов, которые легко реагируют как с молекулами оксида углерода по схеме, показанной на рис. 2.2, так и с молекулами водорода (см. рис. 2.1).
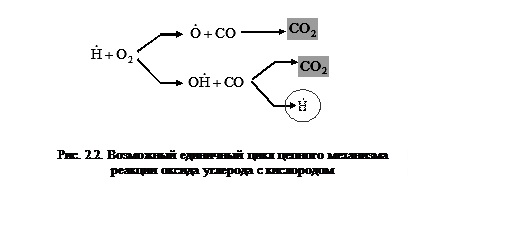
Возможны и другие варианты развития цепи, которые в итоге приводят к образованию стабильной молекулы диоксида углерода:
![]() и
и ![]() , (2.10)
, (2.10)
![]() и
и ![]() . (2.11)
. (2.11)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.