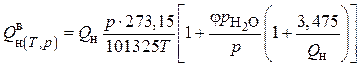 ,
(2.15)
,
(2.15)
где ![]() — теплота сгорания сухого газа при нормальных условиях, МДж/м3;
— теплота сгорания сухого газа при нормальных условиях, МДж/м3;![]() — относительная влажность газа (безразмерная величина);
— относительная влажность газа (безразмерная величина); ![]() — парциальное
давление водяного пара, Па.
— парциальное
давление водяного пара, Па.
Для предварительно осушенных газов в городских системах газораспределения и газопотребления значение комплекса в квадратных скобках мало отличается от единицы и в технических расчетах может не учитываться.
**********************************************************
Пример 2.1
Природный газ имеет следующий объемный состав, %: CH4 = 97; C2H6 = 2; C3H8 = 0,3; C4H10 = 0,2; N2 = 0,3. Определить низшую теплоту сгорания газа.
Решение
По выражению (2.14), используя данные табл. 2.1 для
отдельных компонентов, получим ![]() :
:
![]()
3.Материальный баланс
реакций горения
3.1. Теоретический объем воздуха для горения
Стехиометрические уравнения учитывают теоретическое взаимодействие горючих компонентов непосредственно с кислородом. В реальных условиях кислород в зону реакции подается с воздухом, как его составная часть. Если пренебречь незначительным содержанием диоксида углерода и инертных газов в составе сухого воздуха, то можно считать, что воздух является смесью кислорода и азота в соотношении:
|
Объемный состав, % об. |
Массовый состав, % мас. |
|
|
кислород O2 |
21,0 |
23,2 |
|
азот N2 |
79,0 |
76,8 |
Следовательно, чтобы
доставить в зону горения l м3 кислорода,
в действительности необходимо доставить туда
![]() м3 воздуха,
поскольку каждому l м3 кислорода
сопутствует
м3 воздуха,
поскольку каждому l м3 кислорода
сопутствует ![]() м3 азота, не принимающего участия в
горении. Поскольку
1 моль любого газа (если считать его
идеальным газом) в одинаковых условиях занимает одинаковый объем,
реакции горения водорода и метана в сухом воздухе можно
представить следующим образом:
м3 азота, не принимающего участия в
горении. Поскольку
1 моль любого газа (если считать его
идеальным газом) в одинаковых условиях занимает одинаковый объем,
реакции горения водорода и метана в сухом воздухе можно
представить следующим образом:
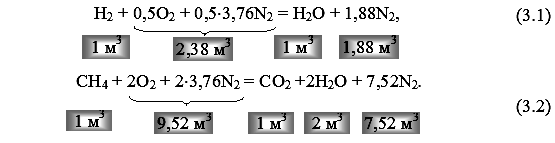
Аналогичным образом реакцию горения произвольного углеводорода в сухом воздухеможно представить в виде
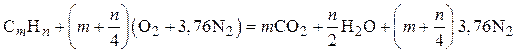 . (3.3)
. (3.3)
Значения теоретического объема кислорода и воздуха для горения различных газов и соответствующего объема продуктов сгорания приведены в табл. 3.1.
|
Газ |
Объем окислителя, м3/м3 газа |
Объем продуктов сгорания, м3/м3 газа |
||||||||||||||||
|
O2 |
Воздуха |
CO2 |
H2O |
N2 |
Всего |
|||||||||||||
|
Водород |
0,5 |
2,38 |
— |
1,0 |
1,88 |
2,88 |
||||||||||||
|
Диоксид углерода |
0,5 |
2,38 |
1,0 |
— |
1,88 |
2,88 |
||||||||||||
|
Метан |
2,0 |
9,52 |
1,0 |
2,0 |
7,52 |
10,52 |
||||||||||||
|
Этан |
3,5 |
16,66 |
2,0 |
3,0 |
13,16 |
18,16 |
||||||||||||
|
Пропан |
5,0 |
23,80 |
3,0 |
4,0 |
18,80 |
25,80 |
||||||||||||
|
Бутан |
6,5 |
30,94 |
4,0 |
5,0 |
24,44 |
33,44 |
||||||||||||
|
Пентан |
8,0 |
38,08 |
5,0 |
6,0 |
30,08 |
41,08 |
||||||||||||
|
Этилен |
3,0 |
14,28 |
2,0 |
2,0 |
11,28 |
15,28 |
||||||||||||
|
Попилен |
4,5 |
21,24 |
3,0 |
3,0 |
16,92 |
22,92 |
||||||||||||
|
Бутилен |
6,0 |
28,56 |
4,0 |
4,0 |
22,56 |
30,56 |
||||||||||||
|
Пентилен |
7,5 |
35,70 |
5,0 |
5,0 |
28,20 |
38,20 |
||||||||||||
|
Ацетилен |
2,5 |
11,90 |
2,0 |
1,0 |
9,40 |
12,40 |
||||||||||||
Для сложных газов
теоретический объем сухого воздуха для горения ![]() , м3/м3 газа, можно
определить, используя стехиометрические объемы для отдельных компонентов
(подставляя их процентное содержание в газе):
, м3/м3 газа, можно
определить, используя стехиометрические объемы для отдельных компонентов
(подставляя их процентное содержание в газе):
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.