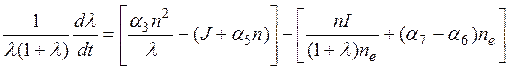 .
.
Оценка величин отдельных слагаемых показывает, что можно пренебречь ионизацией и рекомбинацией (последние квадратные скобки) Тогда
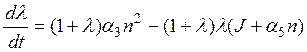 ,
,
где, напомним, a3 – характеризует скорость прилипания электронов, J - фотоотлипания, а a5 - отлипания в результате столкновений.
Оказывается, что постоянная времени процесса образования отрицательных ионов путем прилипания[7] составляет не более 1 часа на высотах около 120 км и намного меньше на меньших высотах, то есть, свободные электроны весьма быстро расходуются на образование отрицательных ионов. Поэтому можно считать, что в течение короткого времени устанавливается равновесие, и тогда для стационарного случая имеем
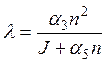 .
.
Таким образом, отношение количества отрицательных ионов и электронов зависит от скорости прилипания электронов к нейтральным частицам и от скорости отлипания под действием солнечного излучения и столкновений.
Коль скоро ![]() из (10.8') получаем
из (10.8') получаем
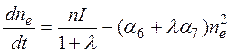 ,
,
где a6 определяет скорость рекомбинации положительных ионов и электронов, a a7 - рекомбинации положительных и отрицательных ионов. В частности, это годится для области D. Расчеты с использованием полученной формулы показывают, что в интервале 60-75 км величина l уменьшается от ≈102 до ≈10-2, то есть на 4 порядка.
В области Еl << 1. Поэтому возможны дальнейшие упрощения:
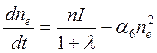 .
.
При более детальном анализе следует учитывать образование нескольких типов ионов. Уравнения при этом, конечно, усложняются.
Здесь ионы образуются в основном за счет фотоионизации молекулярного азота и молекулярного кислорода солнечным ультрафиолетовым и рентгеновским излучениями. Образуется также небольшое количество ионов NO+ и О+ в результате прямой ионизации. Эти первичные ионы затем участвуют во множестве химических реакций, приводящих к образованию других, вторичных ионов, и в реакциях рекомбинации, устанавливающих баланс между образованием и уничтожением ионов [29].
Первичные ионы О2+ образуются в большом количестве, а их разрушение в реакциях диссоциативной рекомбинации
![]() (10.12)
(10.12)
и ионно-молекулярной реакции с NO
![]() (10.13)
(10.13)
происходит весьма медленно. Наоборот, ионы N2+ являются очень короткоживущими из-за быстрой реакции
![]() . (10.14)
. (10.14)
Реакция (10.14) является дополнительным источником О2+. Однако ионы N2+ реагируют также с атомами О, образуя NO+ (атомов О в области Е достаточно много):
![]() .
(10.15)
.
(10.15)
Значения a14 и a15 сравнимы, поэтому роль каждого процесса зависит от соотношения концентраций О2 и О. Ниже уровня 100 км доминирует реакция (10.14). Кроме перечисленных реакций нужно также учитывать диссоциативную рекомбинацию NO+:
![]() .
(10.16)
.
(10.16)
Предполагая существование фотохимического равновесия и пренебрегая медленными реакциями, а также не учитывая малую концентрацию N2+, находим
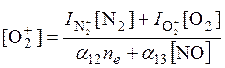 ,
,
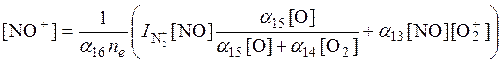 .
.
Уравнение
электронейтральности в области Е имеет вид ![]() , то есть, игнорируются другие положительные ионы и все
отрицательные ионы (и тех и других мало в области E).
, то есть, игнорируются другие положительные ионы и все
отрицательные ионы (и тех и других мало в области E).
Добавим, что образовавшиеся в результате первичной ионизации ионы О+ быстро исчезают в реакциях с O2, N2 и СO2, поэтому они играют весьма малую роль в этой области. Здесь максимальная концентрация О+ составляет не более 10% от концентрации О2+.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.