![]() (7.8)
(7.8)
то анализ таких диффузионных процессов можно осуществлять в рамках одномерных задач.
Активность диффузионных процессов определяется коэффициентом диффузии. Температурную зависимость коэффициента диффузии представляют в виде уравнения Аррениуса
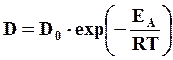 (7.9)
(7.9)
где D0 – постоянная, зависящая от вещества; ЕА – энергия активации; R – газовая постоянная; Т – абсолютная температура процесса.
Физический смысл энергии активации состоит в том, что она представляет высоту потенциального барьера, который атом должен преодолеть при переходе их одного равновесного состояния в другое. Численные значения D0 и EA почти не зависят от температуры, но очень чувствительны к изменениям структурного и химического характера. Энергия активации одного элемента при его диффузии в различной матрице принимает разные значения, причем, чем больше химически отличаются атомы матрицы и диффузанта, тем меньше энергия активации. Наибольшее значение энергия активации имеет место при самодиффузии. Это объясняется тем, что при уменьшении химического различия между атомами прочность их связи в кристаллической структуре возрастает. Прочность атомарной связи определяет температуру плавления, поэтому для большинства материалов справедливо эмпирическое линейное соотношение между энергией активации диффузии и температурой плавления
![]()
где Тпл – температура плавления; А – постоянная, зависящая от единиц измерения (если энергию активации представлять в ккал/г-атом, то А = 18; если энергию активации представлять в кДж/к.моль, то А = 7,536.104).
Скорость диффузии экспоненциально зависит от температуры, при этом выделяют температуру начала заметной диффузии, экспериментально определяемую по сопротивлению току газа при спекании порошка. Эта температура называется таммановская температура. Величина таммоновской температуры для разных материалов принимает свои значения и для металлов примерно составляет 30…40% от температуры плавления.
Большое влияние на коэффициент диффузии и энергию активации оказывают дефекты кристаллического строения. Повышение плотности дефектов кристаллического строения увеличивает скорость и коэффициент диффузии, снижает энергию активации.
7.3. Механизмы диффузии в металлах
Прочес диффузии связан с перемещением атомов из одного положения в другое. Для осуществления такого перемещения, атом должен обладать энергией активации, обеспечивающей преодоление потенциального барьера. Величина энергии активации зависит от местоположения атома и наличия дефектов кристаллического строения. Энергия активации и внешние энергетические условия определяют механизмы диффузии.
Выделяют несколько возможных механизмов перемещения атомов, основными из которых являются (рис.7.1):
- диффузия путем прямого одновременного обмена местами двух или большего числа атомов;
- межузельный механизм диффузии атомов внедрения;
- вакансионный механизм.
Диффузия путем прямого обмена может осуществляться несколькими способами. Однако одновременный обмен местами пары атомов в совершенной решетке (рис. 7.1.а) требует для преодоления потенциального барьера значительной энергии, поэтому наиболее вероятным для этого механизмом является групповое смещение, например в кольцевой последовательности (рис. 7.1.б). При таком обмене также будут наблюдаться значительная деформация кристаллической структуры, но в расчете на отдельный атом она будет меньше, чет при прямом обмене пары атомов.
Межузельный механизм диффузии иллюстрируется рис. 7.1.в. Элементарный акт межузельного механизма диффузии состоит в миграции собственных или чужих атомов в межузелье кристаллической структуры. Такие перемещения сопровождаются деформацией кристаллической решетки, но энергия, необходимая для преодоления возникающего при этом поля напряжений, значительно меньше, чем при прямом обмене. Чем меньше размер атома диффузанта, тем меньше требуется энергии для его перемещения и выше скорость диффузии. Наиболее просто процесс межузельной диффузии осуществляется в твердых растворах внедрения.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.