4.
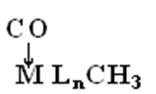 → MLn(CО-CH3) -
внедрение π - координированного карбонильного лиганда по σ -связи
→ MLn(CО-CH3) -
внедрение π - координированного карбонильного лиганда по σ -связи
М-СН3.
Лекция №5
Геометрический и энергетический факторы в катализе
Адсорбция физическая и химическая. Изостерическая и дифференциальная теплоты адсорбции. Изотермы адсорбции Генри, Ленгмюра, Фрейндлиха, Темкина, БЭТ, Дубинина.
21
Геометрический и энергетический факторы в катализе
1. Наиболее обоснованной теорией катализа следует считать теорию химической связи, где отмечалось геометрическое соответствие d - орбиталей переходных металлов и большинства субстратов.
2. Параметры кристаллической решетки Ni, Pt и др. катализаторов гидрирования бензола соответствуют геометрии бензольного кольца:
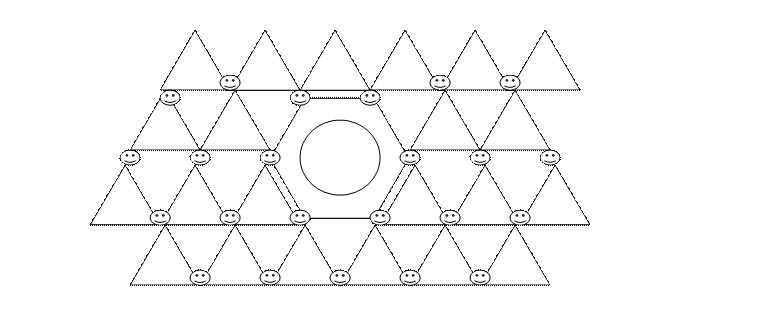
3. Размеры d - орбиталей у наиболее активных в гидрировании этилена металлов хорошо соответствуют размерам разрыхляющих π* - орбиталей этилена.
4. Очевидно, что эффективное взаимодействие катализатора и органических соединений возможно только при геометрическом соответствии конфигураций орбиталей как по геометрии так и по знаку волновых функций т.е. при соответствующей симметрии взаимодействующих орбиталей.
Энергетический фактор в катализе
22
В оптимальном каталитическом процессе скорость адсорбции исходных веществ равна скорости десорбции продуктов реакции. Равенству скоростей примерно соответствует равенство теплоты адсобции и десорбции при том, что их сумма равна тепловому эффекту реакции. При равновесных стадиях константа адсорбционного равновесия близка к константе десорбционного:
Кадс = е-ΔGадс/RT
Кдес = е-ΔGдес/RT
ΔGадс = ΔGдес или ΔНадс -TΔSадс = ΔHдес - TΔSдес
ΔSадс ≈ - ΔSдес т.к. при адсорбции энтропия Системы уменьшается а при десорбции снова возрастает. Поэтому в оптимальном процессе:
ΔHадс ≥ ΔНдес
Адсорбция физическая и химическая.
Физическая адсорбция обусловлена силами межмолекулярного взаимодействия, теплота – примерно 10 кдж/моль.
Химическая адсорбция – сопровождается значительным перераспределением электронной плотности, теплота химической адсорбции – от 80 до 100 кдж/моль.
Разновидности адсорбции:
Обратимая – необратимая
Специфическая – неспецифическая
В один слой - многослойная
Диссоциативная – с диссоциацией субстрата, например водорода.
23
Теплота адсорбциии
Дифференциальные характеристики, изменяются при изменении доли занятой поверхности:
Изостерическая теплота адсорбции:
gisost = ΔHg - ΔHs
ΔHg - мольная энтальпия адсорбируемого вещества.
ΔHs - парциальная мольная энтальпия адсорбированного вещества.
Изостерическая – при постоянной доле занятой поверхности θ.
Дифференциальная теплота адсорбции:
gd = ΔUg - ΔUs
ΔUg - мольная внутренняя энергия адсорбируемого вещества.
ΔUs - парциальная мольная внутренняя энергия адсорбированного вещества.
Адсорбция при постоянной доле занятой поверхности θ.
gisost = gd + RT
Интегральная теплота адсорбции относится к постоянному поверхностному давлению φ и рассчитывается аналогично дифференциальным величинам.
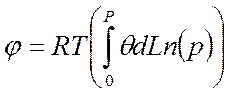
24
Обратимая адсорбция
В изобарно – изотермических условиях справедливо уравнение типа Клаузиуса – Клапейрона:
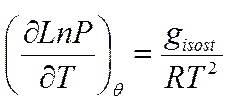
Для обратимой адсорбции изостерическая теплота адсорбции близка экспериментально определенной:
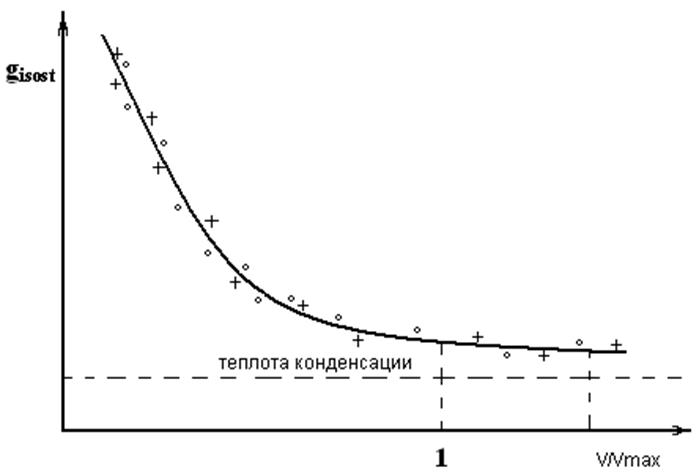
+ изостерическая теплота адсорбции.
○ экспериментально определенная теплота адсорбции.
V/Vmax - степень заполнения поверхности.
25
Изотермы адсорбции
1. V = kP - Уравнение Генри
двумерный идеальный газ на эквипотенциальной поверхности при минимальной степени заполнения gадс.= const..
2. V/Vmax = θ = kP/(1 + kP) - изотерма Ленгмюра
двумерный идеальный газ на эквипотенциальной поверхности при различной степени заполнения gадс.= const.
3. θ = кР1/n изотерма Фрейндлиха
нет межмолекулярного взаимодействия, gадс.= g0 е-кθ
4. θ = (1/a)(LnA0 )P - изотерма Темкина (Шлыгина – Фрумкина)
gадс.= g0 (1 - α θ) теплота адсорбции линейно уменьшается при заполнении поверхности
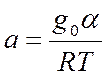
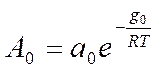
a0 и α - const.
5. 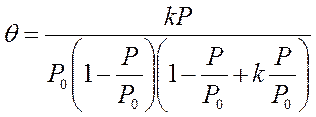 Уравнение
БЭТ
Уравнение
БЭТ
Физическая полислойная адсорбция, однородная эквипотенциальная поверхность.
26
6. Lnθ=-BLn(P0 /P) Уравнение Дубинина
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.