1
Лекции по гетерогенному катализу.
Лекция № 1
Энтропийная и активационная природа катализа в соответствии с теорией переходного состояния.
Твердые кислоты и основания. Силикагель. Окись алюминия. Алюмосиликаты. Цеолиты.
Энтропийная и активационная природа катализа.
Катализатор – вещество, изменяющее скорость химической реакции, но по ее окончании остающееся в неизменном количестве.
Катализатор изменяет константу скорости химической реакции:
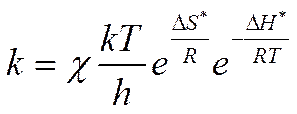
Активационная
природа катализа состоит в увеличении
скорости реакции в результате образования комплекса катализатора с
промежуточными веществами, обладающего низкой энергией, в результате чего
уменьшается энергия активации Еа = ∆H![]() .
Чисто арифметически – увеличивается
.
Чисто арифметически – увеличивается 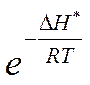
Энтропийная
природа катализа состоит в увеличении
скорости реакции в результате образования комплекса катализатора с исходными
веществами, обладающего низкой энтропией, в результате чего увеличивается
энтропия активации ∆S![]() . Чисто арифметически –
увеличивается
. Чисто арифметически –
увеличивается 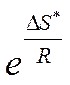
2
Твердые кислоты и основания. Силикагель. Окись алюминия. Алюмосиликаты. Цеолиты.
Силикагель.
Гель кремниевой кислоты Si(OH)4 после дегидратации и сушки:
SiO2 •хН2О состав силикагеля
Si------O------Siсилоксановая связь
Si------OHсиланольная группа
Строение: неорганический полимер, содержащий кислотные центры Бренстеда в количестве 2.5 – 4.5 кислотных групп на один квадратный нанометр.
Идентификация: ИК – спектры рентгеноаморфного силикагеля, титрование растворами LiAlH4, RLi.
Окись алюминия.
Al2O3 •хН2О состав окиси алюминия
Al□ кислотный центр Льюиса
Al--ОН кислотный центр Бренстеда
Строение: неорганический полимер, содержащий кислотные центры Бренстеда и Льюиса.
Идентификация: ИК – спектры показывают пять типов кислотных центров Бренстеда.
Замена части кислорода на фтор или хлор увеличивает силу кислотных центров.
3
Алюмосиликаты.
Al2O3 • м SiO2 •хН2О
Al□ кислотный центр Льюиса
Al--ОН кислотный центр Бренстеда
Si--OHсиланольная группа
Строение: неорганический полимер, содержащий кислотные центры Бренстеда и Льюиса.
Цеолиты.
Me(2/n)O • Al2O3 • м SiO2 •хН2О
n – заряд металла
м – силикатный модуль, мольное соотношение SiO2 / Al2O3
Строение: неорганический полимер, имеющий регулярную кристаллическую структуру, содержащий кислотные центры Бренстеда и Льюиса.
Элементарная ячейка – кубооктаэдр (содалитовая ячейка) – содержит в вершинах: 24 иона Al3+ и Si4+
содержит в ребрах: 36 ионов О2-
4
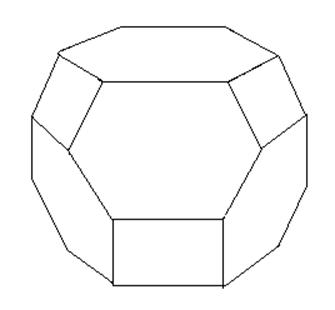
Правило Лёвенштейна: связь между группами (AlO4)- неустойчива.
Виды цеолитов
|
Тип цеолита |
название |
модуль |
Размер окон в полости, нм. |
|
А |
Тип А |
1.9 +- 0.9 |
0.3 – 0,5 |
|
Х |
Фожазиты |
2.5 +- 0.5 |
0.75 – 1 |
|
Y |
Фожазиты |
3-6 и более |
0.75 – 1 |
|
Морденит |
Морденит |
5-10 и более |
0.67 – 0.7 |
В цеолитах типа А содалитовые ячейки связаны через прямоугольные плоскости и образуют маленькие окна в полости.
В цеолитах типа Х и Y содалитовые ячейки связаны через шестиугольные плоскости и образуют большие окна в полости.
Морденит, имеющий идеализированную формулу:
Na8 • (AlO2 )8 • (SiO2 )40 • 24Н2О ZSM - 5
образует структуру из пятичленных колец, связанных в цепи, которые в свою очередь образуют эллиптические каналы с большим диаметром 0.7 нм и малым диаметром 0.67 нм. Основные каналы связаны меньшими по диаметру каналами в 0.39 нм., имеющими сужения до 0.28 нм и менее, направленными
5
перпендикулярно эллиптическим. Диффузия реагентов в морденитах происходит исключительно по эллиптическим каналам.
Строение и свойства цеолитов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.