1. Высокая работа выхода электрона Евых. = ЕF если не учитывать потенциал поверхности металла.
2. Высокая плотность занятых квантовых состояний на поверхности Ферми N(EF) и наличие вакансий рядом с поверхностью Ферми.
16
3. При выполнении условий 1 и 2 максимально крутая кривая распределения вблизи поверхности Ферми т.е dN(EF)/dE = max .
|
металл |
Электронная конфигурация атомов |
Заполнение валентных зон в кристалле |
|
Fe |
3d6 4s2 |
3d7,054s0,95 |
|
Ni |
3d84s2 |
3d9,454s0,55 |
|
Pd |
4d105s0 |
4d9,645s0,36 |
|
Pt |
5d96s1 |
5d9,76s0,3 |
|
Cu |
3d104s1 |
3d104s1 |
Данные таблицы подтверждают теорию: каталитические свойства нарастают сверху вниз, но почти отсутствуют у меди.
Катализ на полупроводниках в рамках зонной теории
Уровень энергии Ферми – электрохимический потенциал электрона в твердом теле, вероятность его занятия электронами равна 0.5
Энергетическая диаграмма полупроводника n - типа
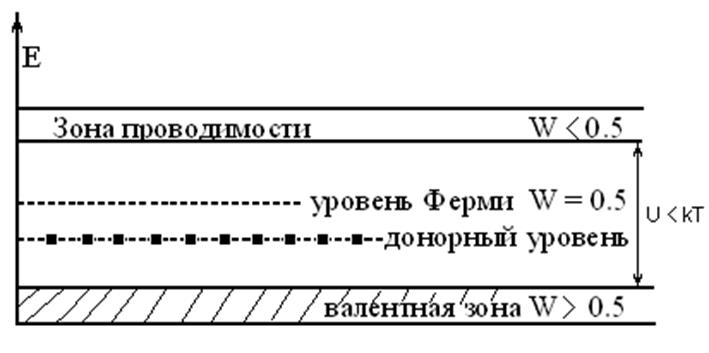
17
U ≤ kT ширина запрещенной зоны, для полупроводников
Энергетическая диаграмма полупроводника р - типа
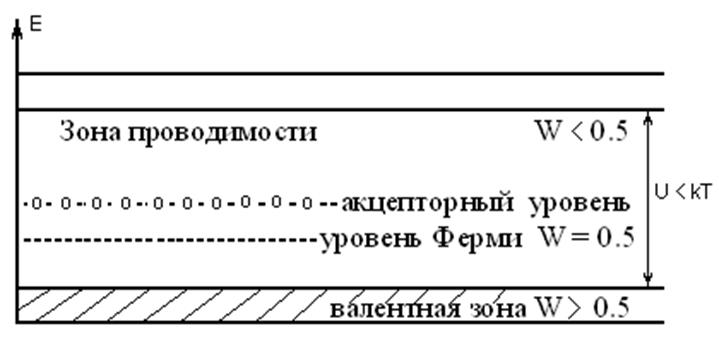
Активные центры полупроводникового катализатора это электроны которые могут перемещаться к субстрату с донорного уровня и вакансии (дырки) на которые могут перемещаться электроны от субстрата обеспечивая его эффективную хемосорбцию:
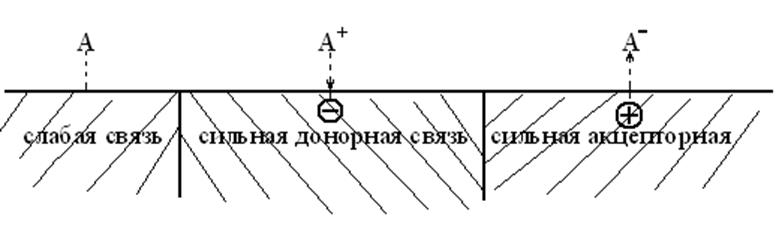
18
Лекция №4
Теория химической связи адсорбция и катализ. Гомогенный катализ, классификация лигандов, обмен лигандов, окислительное присоединение и восстановительное элиминирование, реакции внедрения, правило Толмана.
Теория химической связи адсорбция и катализ
Поверхностные атомы металла согласно теории сохраняют индивидуальные орбитали, хотя и в измененном виде:
Кристалл никеля, имеющий кубическую гранецентрированную решетку, имеет вместо пятикратно вырожденной 3d орбитали два типа d - орбиталей мало отличающихся по энергии:
t2g (dxy , dyz , dxz ) и eg (dx2 - y 2 , dz2 )
dуровень не совсем заполнен: 3d9.45 4s0.55 , связь с субстратом осуществляется аналогично хорошо известным комплексным соединениям:
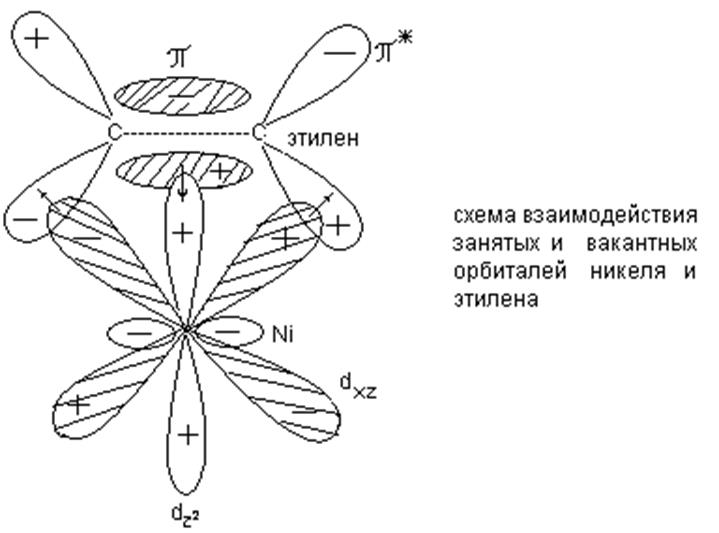
19
Выводы:
1. Электронная плотность перемещается от никеля к этилену и обратно с занятых орбиталей на вакантные.
2. Размеры dxz - орбиталей и знак волновых функций никеля геометрически соответствуют расположению в пространстве связывающих π и разрыхляющих π* - орбиталей этилена.
3. Размеры d - орбиталей элементов восьмой группы мало меняются при переходе от никеля к платине в результате возрастания заряда ядра и силы притяжения электронов к ядру.
4. Наиболее эффективны в катализе рутений, родий, палладий и осмий, иридий, платина имеющие менее электроположительный характер, чем железо, кобальт, никель. В результате платиноиды имеют сопоставимую и при этом небольшую прочность связи с такими разными элементами и соединениями как кислород, водород, этилен, окись углерода и т.д. Образуя поверхностные комплексные соединения с реагентами, платиноид реализует энтропийный и активационный фактор в гидрировании, окислении, восстановлении, карбонилировании и других, в том числе сопряженных процессах.
Гомогенный металлокомплексный катализ.
Правило Толмана – только 16 или 18 валентных электронов образуют устойчивый диамагнитный комплекс.
Число валентных электронов = число электронов с внешней оболочки металла + 2(число лигандов, в том числе групп -СН3 и -Н).
18 электронов на валентном уровне металла – это координационно – насыщенный комплекс.
Классификация лигандов:
1. Лиганд имеет только занятые орбитали:. Cl![]() ,OH
,OH![]() , NH3.
, NH3.
2. Лиганд имеет занятые и вакантные орбитали: СО, РХ3, Н2С=СН2 и др.
20
3. Координация лигандов может происходить по типу σ -свяи и по типу π – связи.
Реакции с участием комлексов металлов:
1. MLn + L1 → ML(n-1)L1 + L обмен лигандов, механизм SN1 или SN2.
2.
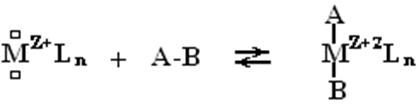
окислительное присоединение, обратная реакция – восстановительное элиминирование.
3.
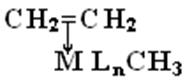 → MLn(CH2-CH2-CH3) - внедрение π - координированного
этиленового лиганда по σ - связи М-СН3.
→ MLn(CH2-CH2-CH3) - внедрение π - координированного
этиленового лиганда по σ - связи М-СН3.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.