5. Карбокатионы превращаются в нейтральные молекулы в результате реакций, обратных реакциям их образования.
Бифункциональный кислотно – основной катализ
Катализ, при котором субстрат подвергается изменениям в двух и более местах одновременно.
Дегидрирование вторичных спиртов на окиси алюминия протекает по согласованному механизму с участием кислотных центров Льюиса и кислорода гидроксильной группы в качестве основания Льюиса
10
.
Причина – пространственное расположение кислотно – основных групп соответствует геометрии субстрата, т.е. каталитическое действие в значительной степени имеет энтропийную природу.
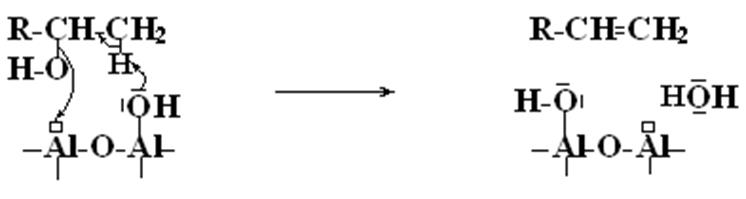
Стрелки указывают направление перемещения электронов
Согласованный механизм циклизации олефинов на окиси алюминия.
Циклизация олефинов в нафтены на окиси алюминия протекает по согласованному механизму с участием кислотных центров Бренстеда и кислорода гидроксильной группы в качестве основания Льюиса.
Причина – пространственное расположение кислотно – основных групп соответствует геометрии субстрата, т.е. каталитическое действие в значительной степени имеет энтропийную природу.
11
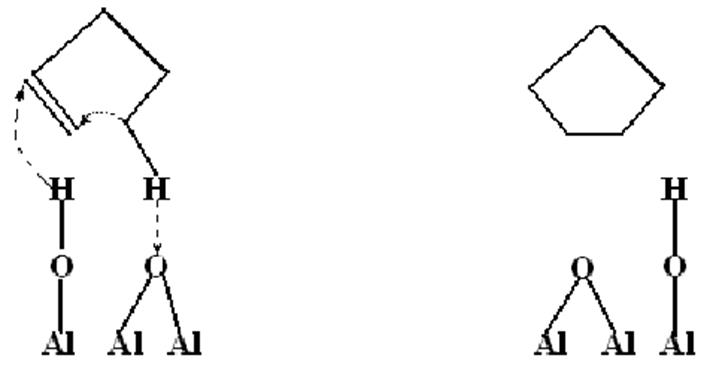
Стрелки указывают направление перемещения атомов.
Лекция №3
Теории гетерогенного катализа. Теория валентных связей Л. Полинга. Статистика Ферми – Дирака и зонная теория строения металлов. Теория Даудена.
Теория валентных связей Л. Полинга.
Каталитическим действием обладают почти исключительно d - элементы, в основном восьмой группы и особенно платиноиды, имеющие почти заполненные валентные орбитали.
Теория предлагает количественные соотношения между каталитическим действием и строением валентных орбиталей.
12
Для никеля электронная конфигурация валентных орбиталей:
|
Форма |
Колич. в процентах |
3d |
3d |
3d |
3d |
3d |
4s |
4p |
4p |
4p |
|
A |
30 |
↑↓ |
↑ |
↑ |
• |
• |
• |
• |
• |
○ |
|
B |
70 |
↑↓ |
↑↓ |
• |
• |
• |
• |
• |
• |
• |
В образовании связей с субстратом могут участвовать 6 электронов для формы А и 7 электронов и вакантных орбиталей (○) для формы В, учитывая соотношение количеств форм А и В получим долю d электронов:
δ = 0.3(2/6) + 0.7(3/7) = 0.4
δ - доля d - электронов, участвующих в образовании связей с субстратом для никеля 0.4 или 40%.
Согласно теории В.С. чем больше δ, тем выше каталитические свойства металла.
Теория в некоторой степени подтверждается экспериментальной линейной зависимостью LnKгидр. от δ для ряда металлов восьмой группы в реакциях гидрирования.
Статистика Ферми – Дирака и зонная теория строения металлов.
Статистика Ферми – Дирака
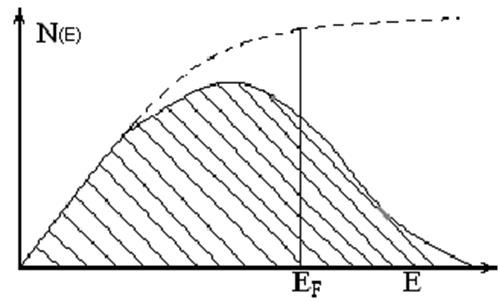
При 0 К, N электронов занимают N/2 уровней вплоть до уровня с максимальной энергией (энергией Ферми) Вероятность занятия электроном уровня с энергией Е при температуре Т равна:
13
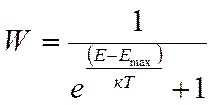
при температуре абсолютного нуля (Т = 0 К)
W = 1 если Е < ЕF ; W=0 если Е > ЕF :
N(E) плотность занятых квантовых состояний, образующих зону.
N(E) = dN/dE
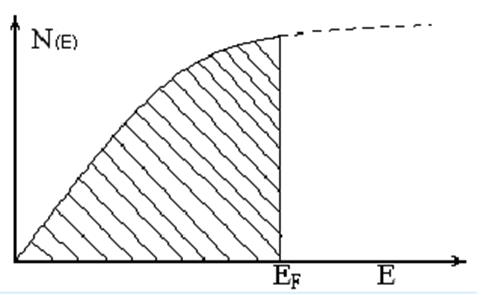
если температура выше абсолютного нуля то:
W=0.5 при Е = ЕF
14
Зонная теория строения металлов.
Расщепление и перекрывание уровней, заполнение d а также s и p зон. Особенности заполнения зон элементов восьмой группы. Зависимость плотности занятых квантовых состояний от их энергии. Теория Даудена. Катализ на полупроводниках в рамках зонной теории
В металлах s,p,d уровни расщепляются и перекрываются с образованием зон.
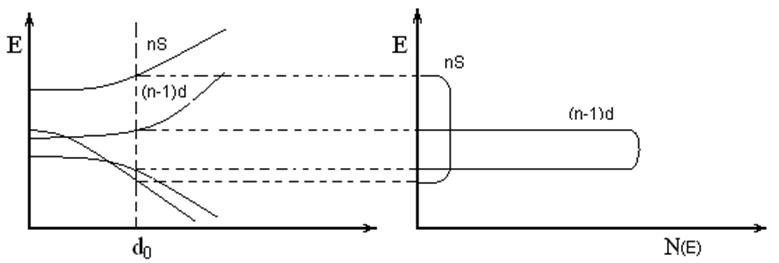
d0 - равновесное расстояние между атомами металла
15
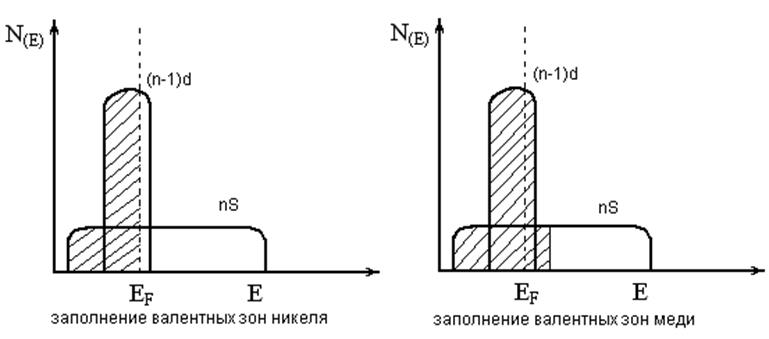
Теория Даудена.
1. Распределение электронов на поверхности близко к распределению в кристалле.
2. Лимитирующая стадия – образование хемосорбированного коплекса.
3. При адсорбции – перемещение электронной плотности от металла на вакантные орбитали субстрата и перемещение электронной плотности от заполненных орбиталей субстрата на неполностью заполненные зоны металла.
Положительным для катализа переходными металлами являются факторы, которые способствует переносу электронной плотности от субстрата к металлу и от металла к субстрату:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.