После синтеза получают цеолиты в Na, Ca, Mg формах. Кислотность возрастает от Na к Mg и тем более к Н форме цеолита. Повышение модуля также резко увеличивает силу кислотных центров. Наиболее кислый цеолит – морденит в Н форме. Замена части атомов алюминия на атомы редкоземельных элементов позволяет регулировать силу и плотность кислотных центров.
Лекция № 2
Оценка кислотности твердой поверхности, прямое титрование, применение адсорбированных индикаторов для определения функции Гаммета Н0.
Теории гетерогенного катализа. Кислотно – основной катализ на твердой поверхности.
Силу кислотных центров определяют после нанесения на поверхность твердой кислоты различных органических индикаторов и последующего изменения их цвета при реакции с кислотными центрами. рН растворов определяют при помощи индикаторной бумаги, на которую нанесены различные органические индикаторы.
Поверхность твердой кислоты с нанесенными органическими индикаторами аналогична индикаторной бумаге, определяющей кислотность.
Количество и силу кислотных центров определяют титрованием образца твердой кислоты в нейтральном неводном растворе бутиламином, пиридином и другими основаниями.
6
Функция Гаммета Н0.
Н+ + В ↔ ВН+ где В - органический индикатор – основание.
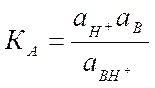
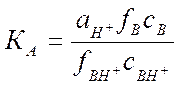
![]()
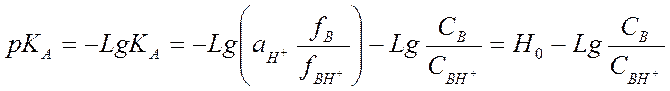
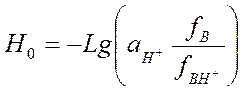
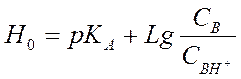
Н0 - функция кислотности Гаммета
1. Адсорбируют кислотно – основной индикатор на твердой поверхности.
2. Экспериментально определяют соотношение СВ и СВН+ по изменению цвета поверхности твердой кислоты с нанесенным на нее индикатором.
3. При известном значении рКА рассчитывают Н0
7
Возможен другой вариант:
1. Адсорбируют кислотно – основной индикатор на твердой поверхности.
2. Титруют бутиламином в неводной среде до изменения окраски индикатора.
3. Используют ряд индикаторов с различными значениями Н0.
Для разбавленных Систем Н0
≈ рН![]()
Теории гетерогенного катализа. Кислотно – основной катализ на твердой поверхности.
1. Адсорбция субстрата на поверхности твердой кислоты.
2. Образование карбокатиона в результате реакции субстрата с твердой кислотой.
3. Реакции карбокатиона, приводящие к целевым продуктам.
4. Десорбция целевых продуктов с поверхности твердой кислоты.
Адсорбция субстрата на поверхности твердой кислоты характеризуется изотермой адсорбции в данных условиях (см. Адсорбция).
Образование Карбокатиона:
1.
RH + HX ↔ R+ + X![]() + H2 кислота Бренстеда и алкан
+ H2 кислота Бренстеда и алкан
2.
RH + □L ↔ R+ + LH![]() кислота Льюиса и алкан
кислота Льюиса и алкан
3. H2C=CHCH3 + HX ↔ H3C-(+)CH-CH3
+ X![]() кислота Бренстеда и алкен
кислота Бренстеда и алкен
4. ![]() + HX ↔
+ HX ↔ 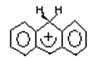 + X
+ X![]() кислота
Бренстеда и арен.
кислота
Бренстеда и арен.
8
5. Другие реакции, не представляющие значительного интереса для промышленности.
Реакции карбокатионов, приводящие к целевым продуктам.
1. Перемещение протона, приводящее к термодинамически более устойчивым разветвленным катионам:
СН3 СН3 СН3
![]()
![]()
![]()
СН3-СН-СН2(+) → СН3-С-СН2 → СН3-СН-СН3
![]()
![]()
2. Скелетная изомеризация, с последующим переносом протона, приводящая к термодинамически более устойчивым разветвленным продуктам:
СН3-СН(+)-СН2-СН3 →
СН3-СН-СН2 → скелетная изомеризация
![]()
СН3-СН-СН2(+) → перенос протона
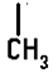
СН3-С(+)-СН3 продукт изомеризации
9
3. Крекинг – полимеризация происходит всегда по β - связи по отношению к карбокатиону:
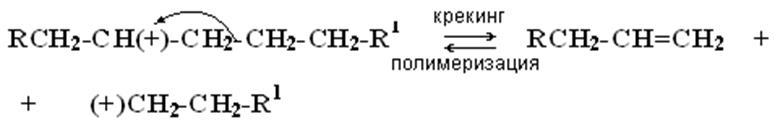
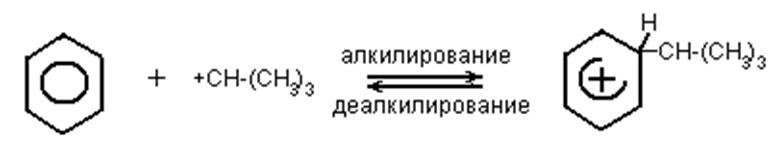
4. Алкилирование – деалкилирование ароматических соединений:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.