
























2. Ферменты
2.1. Строение и механизм действия
Энзимология, учение о ферментах - центральная часть курса биохимии. Многочисленные химические превращения в клетке осуществляются в мягких условиях при температурах, близких к 40 0С, и нейтральных значениях рН. В этих условиях скорости химических превращений ничтожно малы и редко протекают в отсутствие специальных катализаторов - ферментов (энзимы, enzymes). Ферменты — это биокатализаторы, образующиеся в клетке и представляющие собой либо простые белки (например, РНКаза А, см. ниже), либо сложные, содержащие дополнительно не аминокислотные компоненты (практически все ферменты).
Все ферменты обладают отличительными каталитическими свойствами, которые крайне важны для биологических процессов.
Равновесие реакции. Фермент не сдвигает равновесия химической реакции. Ускоряя как прямую, так и обратную реакции, он ускоряет его наступление.
Энергия активации. Ферменты повышают скорость реакции путем снижения энергии активации катализируемых ими реакций.
Каталитическая сила. Ферменты обладают огромной каталитической силой - ускоряют реакцию по крайней мере на шесть порядков.
Так, карбоангидраза, катализирующая гидратирование диоксида углерода:¬
СО2 + Н2О Û Н2СО3,
ускоряет реакцию в 107раз, это самый активный из всех известных ферментов.
Специфичность. Ферменты обладают высокой специфичностью как к катализируемой ими реакции, так и к субстратам.
В качестве примеров различной и увеличивающейся специфичности ферментов можно привести трипсин, который катализирует гидролиз пептидной связи по карбоксильным группам только Lys и Arg. Тромбин (фактор свертывания крови) расщепляет только связь Arg¾Gly. ДНК-полимераза I обладает еще большей специфичностью, задаваемой матрицей ¾ нуклеотид ошибочно включается реже чем один на 106 п.н.
Трансформация различных видов энергии. Энергия реагирующих веществ переходит с высокой степенью эффективности из одной формы в другую: при фотосинтезе энергия света превращается в энергию химических связей; в митохондриях свободная энергия веществ пищи переходит в энергию аденозинтрифосфата (АТР) ¾ разменной монеты энергетической валюты. Эти превращения энергии осуществляются молекулами ферментов, которые являются частью интегральных высокоорганизованных структур.
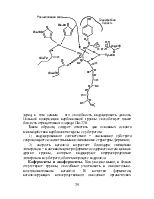
Активный центр (AS, activesite) ¾ участок фермента,ответственный за специфичность связывания субстрата и, собственно, определяющий специфичность каталитического действия фермента. Часть AS,ответственная за селективное связывание субстрата ¾ адсорбционный центр, а часть, которая принимает непосредственное участие в каталитическом процессе ¾ каталитический центр.
(AS)¾ это: 1) малая часть объема фермента; 2) трехмерное образование; 3) узкое углубление или щель. Субстрат относительно слабо связывается с ферментом ¾ константы равновесия
ES-комплексов обычно лежат в пределах 10-2–10-8 М, и специфичность связывания зависит от строго определенного расположения атомов в AS.
Первая стадия ферментативного катализа ¾ образование фермент-субстратного (ES) комплекса. Основным доводом в пользу существования ES-комплексаслужит положение Л. Михаэлиса ¾ скорость реакции достигает максимума при достаточно высокой концентрации субстрата, так как в этих условиях субстрат занимает все каталитические центры на ферменте.
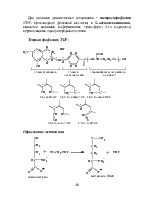
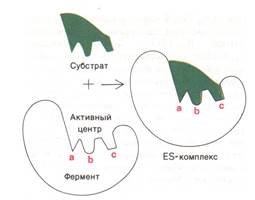
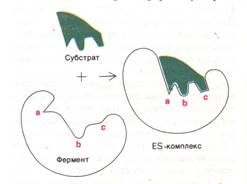
Две модели взаимодействия субстрата с ферментом.
Модель ключ–замок(модель Э. Фишера, А)¾ AS сам по себе комплементарен по форме субстрату.
Модель индуцированного соответствия(модель Д. Кошланда, Б)¾ связывание субстрата изменяет форму фермента и AS становится комплементарным субстрату только после присоединения последнего.
 |
|||
 |
|||
А Б
Три основных типа невалентных взаимодействий, участвующих в образовании ES-комплекса— электростатические, водородные связи и гидрофобные взаимодействия, последние играют важную роль в стерической комплементарности субстрата ферменту.
Скорость ферментативной реакции зависит от:
– концентрации и активности фермента;
– концентрации субстрата;
– рН и состава раствора;
– температуры;
– присутствия активаторов и ингибиторов.
Каждый фермент характеризуется оптимумами рН и температуры.
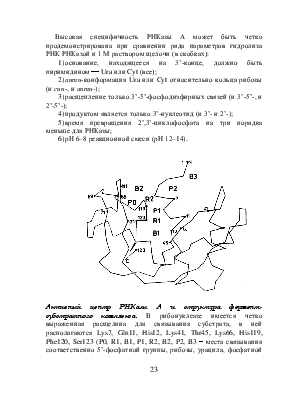
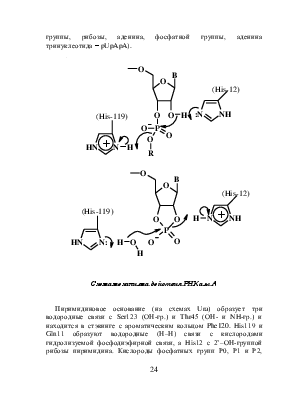
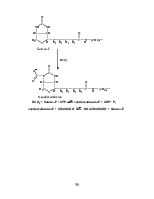
Панкреатическая рибонуклеаза (рибонуклеаза А, РНКаза А, RNase A, ЕС 3.1.27.5). РНКаза А гидролизует РНК в ходе двухстадийного процесса, при котором в качестве промежуточного соединения образуется 2’3’-циклический фосфат (2’,3’-cUMP):
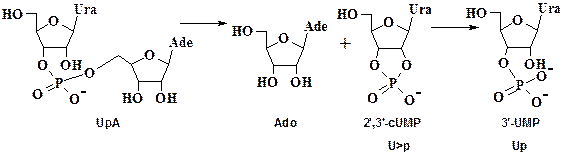
Высокая специфичность РНКазы А может быть четко продемонстрирована при сравнении ряда параметров гидролиза РНК РНКазой и 1 М раствором щелочи (в скобках):
1) основание, находящееся на 3’-конце, должно быть пиримидином ¾ Ura или Cyt (все);
2) анти-конформация Ura или Cyt относительно кольца рибозы (и син-, и анти-);
3) расщепление только 3’-5’-фосфодиэфирных связей (и 3’-5’-, и 2’-5’-);
4) продуктом является только 3’-нуклеотид (и 3’- и 2’-);
5) время превращения 2’,3’-циклофосфата на три порядка меньше для РНКазы;
6) рН 6–8 реакционной смеси (рН 12–14).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.