Максимальная скорость Vmax отражает число оборотов фермента, если известна концентрация активных центров [Е]0, так как
Vmax = k2[Е]0. Кинетическая константа k2 называется числом оборотов.
Таблица 5
Величины k2 для различных ферментов
|
Фермент
Ацетилхолинэстераза Химотрипсин ДНК-полимераза I |
Число оборотов/cек 600 000 25 000 1000 15 |
Число оборотов фермента - это то количество молекул субстрата, которое превращается в продукт реакции в единицу времени при полном насыщении фермента субстратом. Другими словами, это мера эффективности работы фермента. Самым активным из известных ферментов является карбоангидраза
(табл. 5).
Методы определения величин КМ и Vmax. Кинетические константы односубстратной реакции определяют путем измерения скорости реакции при различных концентрациях субстрата (S). Наиболее удобный способ для их расчета - это линеаризация уравнения Михаэлиса–Ментен, графические методы определения константы КМ и Vmax. Ниже представлены графики Лайнуивера-Берка и Иди-Хофсти.
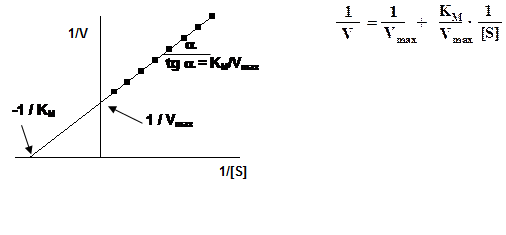 |
|
Статистический анализ показал, что метод Иди–Хофсти дает более точные результаты, чем метод Лайнуивера–Берка, так как в первом случае и зависимые, и независимые переменные входят в величины, откладываемые на обеих осях координат. Очень точный графический метод - «прямой график» Эйзенталя-Корниш-Боудена. Координаты экспериментальных точек откладывают на осях, затем через каждую пару точек проводят прямую. Полученные прямые пересекаются в точке {KM;Vmax}.
Далее приведен график Иди–Хофсти.
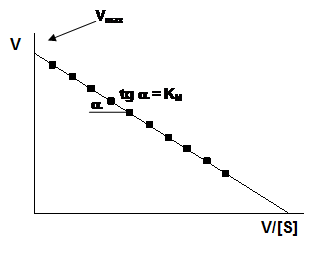 |
 |
Ниже представлен график Эйзенталя–Корниш-Боудена.
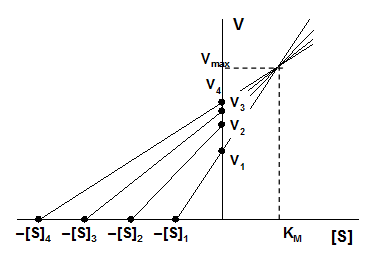 |
Ингибирование и активация ферментов. Эффекторы - соединения, специфично влияющие на скорость ферментативных реакций. Одни из них ускоряют процесс и называются активаторами, другие замедляют и носят название ингибиторов ферментов. По принципу действия ингибиторы делят на обратимые и необратимые.
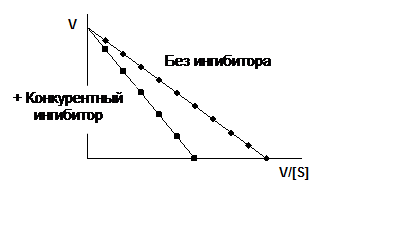
Обратимое ингибирование. Конкурентный ингибитор структурно подобен субстрату и потому связывается в активном центре фермента, вследствие чего препятствует связыванию субстрата в том же центре (см. ниже рисунок). Конкурентный ингибитор уменьшает скорость реакции, снижая долю молекул фермента, связавших субстрат. Неконкурентный ингибитор и субстрат могут связываться молекулой фермента одновременно, т. е. участки их связывания не перекрываются. Неконкурентный ингибитор уменьшает число оборотов фермента, а не снижает долю связавших субстрат молекул фермента.
Конкурентное и неконкурентное ингибирование различаются по кинетике.
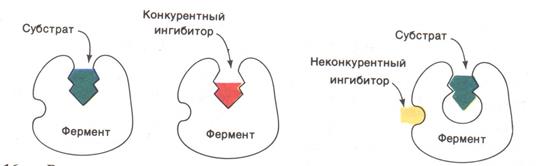
Далее приведена схема конкурентного ингибирования.
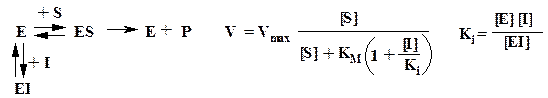
Отличительной особенностью конкурентного ингибирования является способность субстрата при достаточно высокой концентрации (~ 5–10 Км) предотвращать ингибирование, другими словами, защищать фермент.
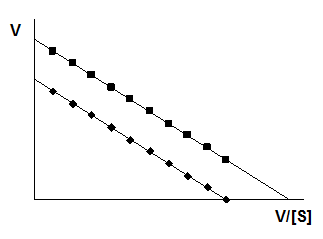
Ниже представлены графики:
Лайнуивера–Берка
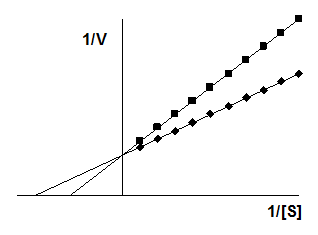
![]()
![]()
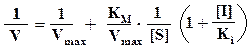 |
|
Иди–Хофсти
|
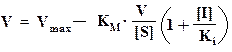
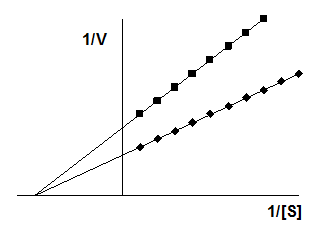
Далее приведена схема неконкурентного ингибирования.
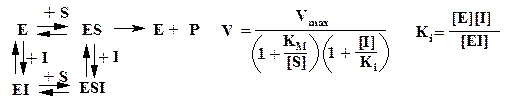
Видно, что при неконкурентном ингибировании Vmax уменьшается, а КМ не изменяется, и повышение концентрации S не снимает ингибирования.
Лайнуивера–Берка
![]()
![]()
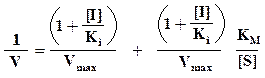 |
Иди–Хофсти
![]()

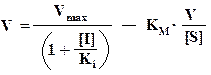 |
2.3. Классы ферментативных реакций. Основные коферменты
Ферменты классифицируются как катализаторы определенных реакций, а не как индивидуальные химические соединения.
Согласно классификации Международного союза по биохимии (IUB), все ферменты разделены на шесть классов, каждый класс – на подклассы и последние, в свою очередь, на подподклассы. Каждый фермент, кроме того, имеет свой порядковый номер внутри подподкласса. Иначе говоря, фермент характеризуется классификационным номером, состоящим из букв КФ (ЕС, Enzyme Classification) и четырех чисел: номера класса, подкласса, подподкласса и порядкового номера. Существует систематическая номенклатура (IUB) ферментов и их тривиальные, общеупотребительные, названия.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.