Гемоглобин- пример белка, в котором гем, связанный со специфическим белком, резко усиливает одну из выполняемых им функций. Образование комплекса гема с белком глобином усиливает координирующую способность гема, в особенности в отношении О2. Гемоглобин (феррогемоглобин - Fe+2) обратимо связывает кислород и таким образом служит переносчиком кислорода в многоклеточных организмах. Гемоглобин - аллостерический белок, присоединение О2 к белку повышает связывание дополнительных молекул О2, то есть имеет место кооперативное связывание.
Цитохром С(ЕС 1.9.3.1.) - небольшой белок, ковалентно связанный с гемом – единственный белковый переносчик электронов на кислород в процессе окислительного фосфорилирования, характерного для всех аэробных организмов.
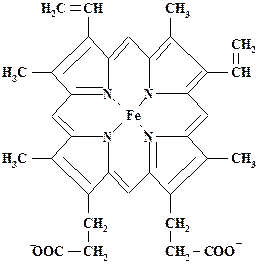
Каталаза (ЕС 1.11.1.6.) осуществляет расщепление перекиси водорода до молекулярного кислорода и воды, защищая живые организмы от повреждения высокореакционноспособным пероксидом водорода:
Н2О2 + Н2О2 ® 2Н2О + О2
Пиридоксальфосфат (PLP) - простетическая группа, активная форма которой образуется как шиффово основание в результате конденсации альдегидной группы со свободной e-аминогруппой остатка Lys фермента и затем реагирует со специфичной аминокислотой с образованием нового шиффова основания, при этом освобождается e-аминогруппа Lys.
Пиридоксальфосфат - кофермент большой группы ферментов (лиаз, ЕС 4.), катализирующих декарбоксилирование
a-аминокислот (с образованием аминов):
H+
RCH(NH3+)COO- ® RCH2NH3+ +CO2
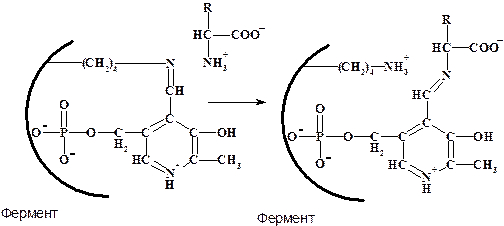
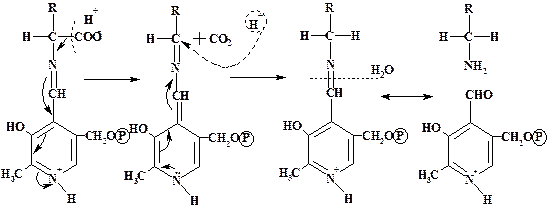
Пиридоксальфосфат является коферментом еще одной группы ферментов - аминотрансфераз(ЕС 2.6.1.), или трансаминаз, катализирующих реакции переаминирования общего вида:
R1–CH–COO- + R2–C–COO- → R1–C–COO- + R2–CH–COO-
NH2 O O NH2
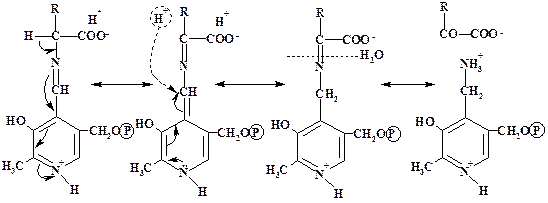 Альдимин Хиноидное РМР-Кетимин Пиридоксамин-фосфат
Альдимин Хиноидное РМР-Кетимин Пиридоксамин-фосфат
соединение PMP
Этот ряд превращений представляет собой одну из двух полуреакций, необходимых для ферментативного переаминирования. РМР реагирует со второй специфичной кетокислотой в обратном направлении с образованием исходного шиффова основания PLP с NH2-группой Lys апофермента и аминокислоты:
![]() R1–CH–COO- +
PLP → R1–C–COO- + PMP
R1–CH–COO- +
PLP → R1–C–COO- + PMP
NH2O
![]() PMP
+ R2–C–COO- → R2–CH–COO- + PLP
PMP
+ R2–C–COO- → R2–CH–COO- + PLP
ONH2
Таким образом, белок в роли фермента или апофермента участвует в следующих главных процессах:
· Белок обеспечивает специфическое узнавание субстрата и последующее образование продуктивного фермент-субстратного комплекса.
· Кислые и основные аминокислотные остатки фермента участвуют в общем кислотно-основном катализе.
· В ряде случаев фермент ковалентно связывает субстрат с образованием промежуточного продукта и выступает как нуклеофильный катализатор.
· В качестве апофермента белок обеспечивает ковалентное связывание в активном центре кофактора, простетической группы или обратимое связывание кофермента, а также определяет их функцию.
2.2. Кинетика ферментативных реакций
![]()
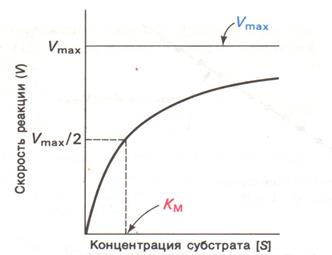
Для описания кинетики, представленной на графике и описывающей действие многих ферментов, в 1913 г. Л. Михаэлис и М. Ментен предложили простую модель, в основе которой лежит необходимый промежуточный этап катализа - образование фермент-субстратного комплекса (ES) (1).
Кроме того, существует еще ряд ограничительных условий (они будут указаны по порядку в скобках), при выполнении которых модель и выведенное ниже уравнение Михаэлиса–Ментен правильно описывают кинетику реакции.
Предложенная модель может быть выражена следующей последовательностью реакций фермента (Е) с субстратом (S), при этом, с каждым активным центром Е связывается только одна молекула S (2):
k1 k2
![]() E + S ES® E + P. (I)
E + S ES® E + P. (I)
k-1
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.