Активный центр карбоксипептидазы и структура фермент-субстратного комплекса. Ион цинка расположен в углублении близко к поверхности молекулы и образует координационные связи (в виде тетраэдра) с остатками двух гистидинов, глутамата и карбонильным кислородом расщепляемой пептидной связи. Рядом с ионом цинка на ферменте имеется большого размера «карман», в который попадает боковой радикал концевого остатка пептидного субстрата.
Субстрат связывается в активном центре благодаря следующим взаимодействиям: отрицательно заряженная концевая карбоксильная группа вступает в электростатическое взаимодействие с положительно заряженной гуанидиниевой группировкой Arg-145; боковой радикал С-концевой аминокислоты (на рисунке – Tyr) связывается в гидрофобном «кармане»;
ОН-группа Tyr-248 образует две водородные связи с NH-группами пептидной связи, одна из которых является гидролизуемой; карбонильный кислород этой же связи вступает в координационную связь с ионом цинка.
Связывание субстрата сопровождается перестройкой активного центра. Гуанидиниевая группа Arg-145 и карбоксильная группа
Glu-270 смещаются на 2Å, связывание карбонильной группы субстрата с ионом цинка вытесняет из тетраэдрического комплекса молекулу воды. Гидроксил Tyr-248 смещается на 12Å.
Химический механизм действия карбоксипептидазы. Гидролиз пептидных субстратов осуществляется по прямому механизму: Glu-270 активирует молекулу воды; образующийся ОН- непосредственно атакует карбонильный атом углерода расщепляемой пептидной связи. Одновременно Tyr-248 отдает протон на ее NH-группу, и в итоге пептидная связь гидролизуется.
Роль цинка. Ион цинка поляризует С=О-группу, стабилизирует на атоме кислорода отрицательный заряд, а атом углерода становится более чувствительным к нуклеофильной атаке. Неполярное окружение иона цинка увеличивает его эффективный

заряд и тем самым – его способность индуцировать диполь. Сильной поляризации карбонильной группы способствует также близость отрицательного заряда Glu-270.
Таким образом, следует отметить два основных аспекта взаимодействия карбоксипептидазы с субстратом:
1) индуцированное соответствие - связывание субстрата сопровождается значительными изменениями структуры фермента;
2) скорость катализа возрастает благодаря смещению электронов - в активном центре фермента содержатся атом цинка и другие группы, которые индуцируют перераспределение электронов в субстрате, облегчая процесс гидролиза.
Коферменты и апоферменты. Как указано выше, в белках отсутствуют группы, способные участвовать в окислительно-восстановительном катализе. В качестве ферментов, катализирующих непосредственное окисление органических молекул кислородом (например, глюкозооксидаза, ЕС 1.1.3.4.), выступают флавопротеиды - апоферменты в комплексе с флавиновыми нуклеотидами: флавинмононуклеотидом (FMN) и флавинадениндинуклеотидом (FAD).
Функция этих коферментов заключается в дегидрировании (перенос протонов и электронов).
Перенос двух протонов и двух электронов от донора к флавину может происходить в две стадии с образованием семихинона в качестве промежуточного продукта. Семихинон содержит атом азота с неспаренным электроном.
Апофермент определяет функцию кофермента. Определяющую роль природы белковой части фермента можно наглядно продемонстрировать на примере гемопротеидов - гем-содержащих белков, и пиридоксальфосфат-зависимых ферментов.
Гемовые простетические группы содержатся в целом ряде важных ферментов. Гем состоит из органической части и атома Fe. Органическая часть - протопорфирин - образован из четырех пиррольных колец, соединенных четырьмя метиленовыми мостиками. К тетрапиррольному кольцу присоединены четыре метильные, две винильные и две пропионатные боковые цепи.
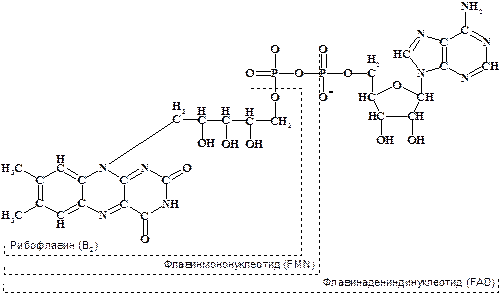
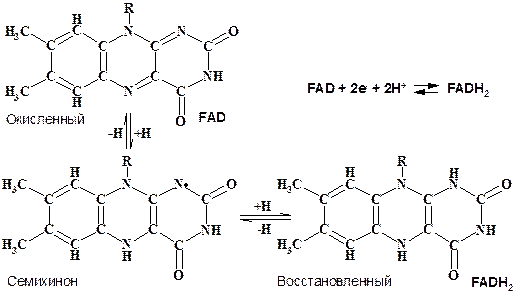
Возможно 15 различных вариантов, в биологических системах присутствует только один изомер - протопорфирин IX. Центральный атом железа в геме способен образовывать шесть связей. Четыре из них расположены в плоскости и связывают атом железа с четырьмя атомами азота плоской структуры порфиринового кольца, а пятая и шестая находятся перпендикулярно по обе стороны кольца и могут образовывать дополнительные связи с определенными лигандами.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.