Подставляя это выражение в уравнение (3), получаем:
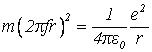 ,
,
Откуда находим частоту обращения электрона вокруг ядра:
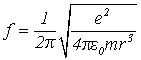 . (7)
. (7)
Подставляя в
это выражение r (полученное выше), е и т для электрона, легко
найти, что ![]() . Это значение также совпадает со
значениями f, найденными с помощью других методов.
. Это значение также совпадает со
значениями f, найденными с помощью других методов.
Несмотря на определенные успехи в объяснении строения атома, достигнутые в рамках планетарной модели и классической теории, перед физиками встал ряд непреодолимых противоречий. Так, согласно законам классической электродинамики:
1) заряженная частица, движущаяся с ускорением, должна непрерывно излучать электромагнитную энергию;
2) частота этого излучения должна быть равна частоте обращения частицы вокруг ядра.
Следовательно,
в соответствии с этой моделью полная энергия атома должна уменьшаться
(становясь все более отрицательной), тогда как частота обращения (формула 7)
должна непрерывно возрастать. Простой расчет показывает, что при этих условиях
за ничтожное время (≈ 10-8 с) электрон упадет на ядро и атом
прекратит свое существование (рис.2). Кроме того, если данная модель верна, то
оптический спектр водорода (как и спектры других элементов) должен быть непрерывным,
а это означает, что все атомы за очень короткое время будут разрушены. Оба
заключения находятся в полном противоречии с экспериментальными данными: атом
является очень устойчивой системой, а оптические спектры газов имеют вовсе не
непрерывное распределение по частоте, а характеризуются набором дискретных
частот, т.е. имеют линейчатую структуру. Все эти факты привели к тому, что
планетарная модель в классическом изложении вскоре была при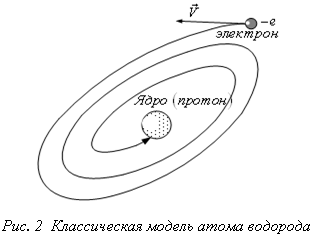 знана несостоятельной.
знана несостоятельной.
2. Атомные спектры
Электрический разряд в трубке, содержащей одноатомный газ под низким давлением, является источником света, анализ которого с помощью призменного спектрографа позволяет обнаружить серию очень отчетливых линий. Эти линии, характеризующие используемый в разрядной трубке газ, называются линейчатым спектром данного газа. Видимая часть спектра водорода называется серией Бальмера, по имени швейцарского физика И. Бальмера, обнаружившего ее в 1885 г. Если в разрядной трубке используется азот, то получается так называемый полосатый спектр, представляющий собой дискретные группы тесно расположенных линий. Этот полосатый спектр характеризует двухатомные молекулы N2 и имеет другое происхождение по сравнению с линейчатыми спектрами. Белый свет от источника излучения с нитью накала, например, от лампы накаливания, характеризуется сплошным спектром и содержит непрерывный набор длин волн. Если такой свет пропустить через одноатомный газ, например, водород, то возникает спектр поглощения. При этом на спектрограмме получается спектр с темными линиями на светлом фоне. Положение этих линий соответствует длинам волн ярких спектральных линий водорода, т.е. газ поглощает падающее излучение именно с этими длинами волн.
Шведский физик-спектроскопист Ю.Р. Ридберг (1854-1919) получил эмпирическую формулу
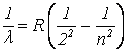 ,
, ![]() , (8)
, (8)
по которой можно
рассчитывать длины волн спектральных линий в серии Бальмера. Здесь R – так называемая
постоянная Ридберга (![]() Å-1). Для
Å-1). Для
![]()
![]() Å
(красная линия Нα), для
Å
(красная линия Нα), для ![]()
![]() Å (голубая линия Нβ);
по мере увеличения n длины волн все больше сближаются, а интенсивности
линий ослабевают. Наконец, при
Å (голубая линия Нβ);
по мере увеличения n длины волн все больше сближаются, а интенсивности
линий ослабевают. Наконец, при ![]() мы получаем
границу серии, когда
мы получаем
границу серии, когда ![]() Å.
Å.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.