Санкт-Петербургский Государственный
Технологический институт
(Технический Университет)
Кафедра химической
технологии пластмасс Факультет IV
Курс 4
Группа 494
Химия и физика высокомолекулярных соединений
Лабораторная работа по теме: Определение кислотного числа
Студент: Шамордина Н. В.
Руководители: Ржехина Е. К.
Каркозов В.Г.
Санкт-Петербург
2002
Определение различных функциональных групп в ВМС позволяет охарактеризовать полученные продукты. Так, по содержанию концевых групп некоторых соединений можно рассчитать молекулярный вес (если он не слишком высок) эпоксидных и полиэфирных смол, полиамидов. Определение функциональных групп в сополимерах даёт возможность рассчитать состав сополимеров. По изменению содержания функциональных групп в процессе поликонденсации можно изучить кинетику процесса.
Определение кислотного числа
Кислотное число – это такое количество щёлочи в миллиграммах, которое потребуется для полной нейтрализации одного грамма кислоты (анализируемого вещества).
В нашей лабораторной работе мы находили практическое кислотное число и, сравнивая его с теоретическим, определяли неизвестное вещество.
Содержание карбоксильных групп и кислотное число определяется титрованием растворённой навески исследуемого вещества щёлочью:
![]() RCOOH + NaOH RCOONa + H2O
RCOOH + NaOH RCOONa + H2O
В зависимости от применяемого растворителя и растворимости вещества используют спиртовой или водный раствор щёлочи.
Реактивы
Растворитель
NaOH, 0,5 н. водный раствор
Фенолфталеин, 1% спиртовой раствор
Приборы
Бюретка ёмкостью 20 мл
Цилиндр мерный ёмкостью 50 мл
Колбы конические ёмкостью 150 мл
Ход определения: В колбу поместили пробу исследуемого вещества, взвешенного на аналитических весах, добавили растворитель и после растворения титровали раствором щёлочи в присутствии фенолфталеина до появления бледно-розовой окраски.
Анализировали две пробы, параллельно проводя контрольный опыт с тем же количеством растворителя. Из полученных результатов приняли среднее значение.
Кислотное число (КЧ) рассчитали по формуле:
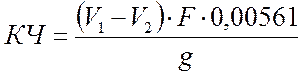 |
,
где: V1 – объём щёлочи, израсходованный на титрование рабочей пробы, мл;
V2 – объём щёлочи, израсходованный на титрование контрольной пробы, мл;
F – поправочный коэффициент раствора щёлочи;
0,00561 – количество COOH групп, соответствующих 1 мл точно 0,1 н раствора щёлочи, г;
g – масса навески исследуемого вещества.
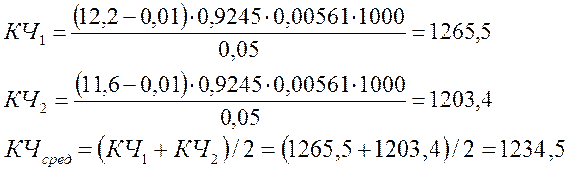 |
Полученное кислотное число соответствует щавелевой кислоте (КЧщавел.теор=1222)
Санкт-Петербургский Государственный
Технологический институт
(Технический Университет)
Кафедра химической
технологии пластмасс Факультет VI
Курс 4
Группа 494
Химия и физика высокомолекулярных соединений
Лабораторная работа по теме:
Количественное определение формальдегида в формалине
Студент: Шамордина Н. В.
Руководители: Ржехина Е. К.
Каркозов В.Г.
Санкт-Петербург
2002
Свойства исследуемого вещества
Формальдегид в обычных условиях – газ со своеобразным запахом, легко растворимый в воде и метиловом спирте. Получается и применяется в виде водного раствора – формалина, содержащего около 40 г формальдегида в 100 мл воды. Смешивается с водой и спиртом. В водных растворах формальдегид находится почти исключительно в гидратированной форме – в виде метиленгликоля:
![]() CH2O + H2O HOCH20H
CH2O + H2O HOCH20H
Формальдегид в водных растворах любой концентрации склонен к уплотнению с образованием полиоксиметилгликолей:
![]() HOCH20H + HOCH20H HOCH20CH20H
+ H2O
HOCH20H + HOCH20H HOCH20CH20H
+ H2O
![]() HOCH20CH20H + n HOCH20H HO(CH2)n+10CH20H
+ n H2O,
HOCH20CH20H + n HOCH20H HO(CH2)n+10CH20H
+ n H2O,
где n = 3 ÷ 4.
Между мономерной и полимерной формами существует равновесие, зависящее от концентрации формальдегида в растворе и температуры.
При длительном хранении, низкой температуре и высокой концентрации формальдегида из формалина выпадает полимер – параформ, представляющий собой смесь полиоксиметиленгликолей с n = 8 ÷ 100, который способен при нагревании расщепляться до метиленгликоля и растворяться в формалине.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.