19.10.2001
![]() k1 B
k1 B
![]() A
A
k2 D
Состав системы:
τ=0 C0A (в момент, когда время равно нулю, т.е. в начале процесса имеется только начальный
продукт начальной концентрации)
τ CA; CB; CD




![]()
![]()
C
CA
CB
CD
τ

![]() ln CA
ln CA
![]()
![]() tg α=k1/k2
tg α=k1/k2
τ
Зная текущие концентрации CA, можем найти константы реакций.
Реакции последовательны, если продукт, получаемый из исходного вещества, расходуется на получение другого вещества.
k1 k2
![]()
![]() A B D
A B D
τ=0: C0A
τ: CA; CB; CD
 |
1. k1≈k2
C
 B
CD
B
CD
![]()
![]()
CA
CB
![]() τ
τ
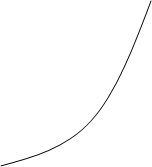
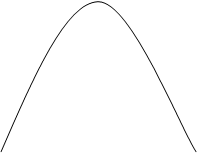
Скорость образования вещества B в начале реакции больше его расхода, в точке B когда концентрация этого продукта равна максимуму, скорости образования и расхода равны, затем, скорость расхода B увеличивается. Концентрация D всё
время увеличивается, при этом в точке B скорость его образования равна максимуму, в этом месте кривая имеет перегиб.
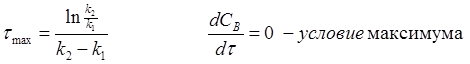 |
1. k1>>k2
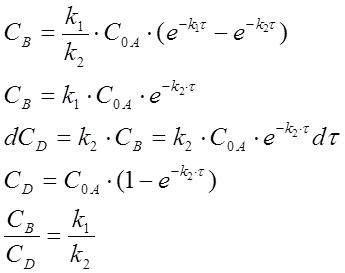
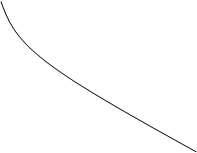
Лимитирующей стадией является образование вещества D
 CD
CD
![]()
 C
C
![]() CB
CB
CA
τ
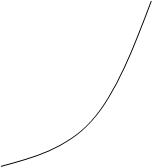
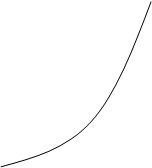
3. k2>>k1
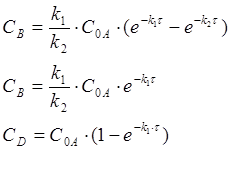
![]()

![]()
![]()
Лимитирующей стадией является образование вещества B
C CD
CA
CB
Τ
Сопряжённые реакции. Работы Шилова.
Это реакции, при которой протекание одной реакции с заметной скоростью возможно лишь при условии протекания другой реакции. Они всегда протекают с образованием общих активных промежуточных веществ.
![]() A+B M
(A – актор, H202)
A+B M
(A – актор, H202)
(B - акцептор, C6H6)
![]() A+D N
(D – индуктор, Fe2+)
A+D N
(D – индуктор, Fe2+)
Пример:
![]()
![]() а) идёт а) C6H6
+ H2O2
идёт только если одновременно проходит р-ция б)
а) идёт а) C6H6
+ H2O2
идёт только если одновременно проходит р-ция б)
![]() только б) H2O2 + Fe2+
только б) H2O2 + Fe2+
совместно с б)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.