. Окончательно: 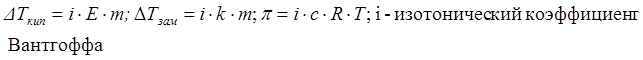
Физический смысл этого коэффициента стал понятен после работ Аррениуса.
Коллигативные свойства это те свойства, которые зависят только от числа частиц, а не от их природы. Сильные электролиты диссоциируют и, следовательно, число частиц увеличивается и тогда их влияние на коллигативные свойства растворов также увеличивается (в случае ассоциации частиц влияние уменьшиться).
Пусть мы имеем n молекул электролита, в результате диссоциации образуется n·ν·α частиц. n·(1-α) – число недиссоциированных частиц.
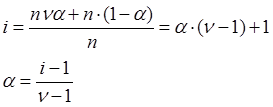
α – можно найти из опыта, определив изотонический коэффициент, либо из измерения электропроводности. Можно считать, что теория Аррениуса верна, т.к. она подтверждается опытами.
Принято считать для сильных электролитов ν=1. Для тех случаев, когда это не выполняется, введён осмотический коэффициент φ=i/υ. Он характеризует неполноту диссоциации и в случае, если она не полная, может отличаться от 1, что обусловлено электростатическими взаимодействиями между ионами и
молекулами растворителя. φ- даёт количественную оценку этого взаимодействия.
По мере разбавления растворов сильных электролитов расстояние между ионами уменьшаются, силы взаимодействия падают и, следовательно, φ→1.
![]()
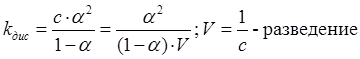 Освальд предложил закон разведения:
Освальд предложил закон разведения:
Все ионные соединения при растворении в полярных растворителях дают растворы, хорошо проводящие электрический ток; i>1.
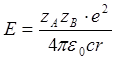 Диполи
молекул растворителя взаимодействуя с ионами кристаллической решётки разрушают
её. Энергия взаимодействия пропорциональна зарядам ионов и определяется законом
Кулона:
Диполи
молекул растворителя взаимодействуя с ионами кристаллической решётки разрушают
её. Энергия взаимодействия пропорциональна зарядам ионов и определяется законом
Кулона:
![]() -
заряды ионов; e – заряд электрона;
-
заряды ионов; e – заряд электрона; ![]() - диэлектрическая проницаемость вакуума, ε
– диэлектрическая проницаемость среды.
- диэлектрическая проницаемость вакуума, ε
– диэлектрическая проницаемость среды.
|
Растворитель |
H2O |
HCN |
HCOOH |
CH3CN |
|
ε |
78 |
107 |
52,5 |
37 |
С ростом ε, E т.е. сила (энергия) притяжения между ионами уменьшается.
Наибольшая степень диссоциации наблюдается для растворов с высокой ε.
С другой стороны, даже в сильный электролит в малополярном растворителе будет малодиссоциированным (слабым). Но иногда и при малой ε, наблюдается сильная диссоциация, что связано с сильным химическим взаимодействием растворённого и растворителя, что приводит к образованию продуктов диссоциации (C2H5OH в HCl)
Теории кислот и оснований
По Бренстеду ( протолитическая теория): кислота – вещество, отщепляющее
протон, а основание – вещество, принимающее его.
![]() 2H2O
H30+ + OH-
2H2O
H30+ + OH-
кислота основание
При записи реакции всегда будет присутствовать пара: кислота и сопряжённое с ней основание.
![]() CH3COOH + NH3 NH4+
+ CH3COO-
CH3COOH + NH3 NH4+
+ CH3COO-
кислота основание кислота основание
![]() (кислота 1) + (основание
1) (кислота 2) + (основание 2)
(кислота 1) + (основание
1) (кислота 2) + (основание 2)
некоторые вещества в разных реакциях способны выступать как в роли кислот, так и в роли оснований, их называют амфотерными. Характерный пример таких реакций – реакции автопротолиза (H20; NH3, многие кислоты).
![]() H2SO4
+ H2SO4 H3SO4+
+ HSO4-
H2SO4
+ H2SO4 H3SO4+
+ HSO4-
![]() H2O
+ H2O H3O+ + OH-
H2O
+ H2O H3O+ + OH-
Эти вещества имеют собственные ионные произведения активности (вода
kw=10-14). pk=-lg a+·a-
|
вещество |
H20 |
H2SO4 |
NH3 |
CH3COOH |
|
pk |
14 |
5 |
32,5 |
16 |
|
pH нейтральной среды |
7 |
2,5 |
16,25 |
8 |
В рамках этой теории можно заново оценить силу кислот. Если растворитель обладает высоким сродством к протону, то многие кислоты в нём становятся в нём сильными, он называется нивелирующим по отношению к кислотам (вода). Ещё более «основным» растворителем, чем вода является жидкий аммиак (NH3 ж),
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.