отсутствует, т.е. ионная атмосфера создаёт такой же потенциал, как и сфера, находящаяся на расстоянии 1/χ от центрального иона с равномерным распределением заряда по поверхности.
Чем меньше 1/χ, тем больше Ψц.а. и сильнее взаимодействие центрального иона.
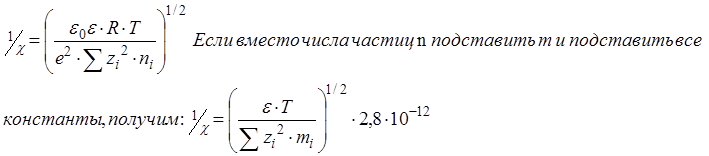 |
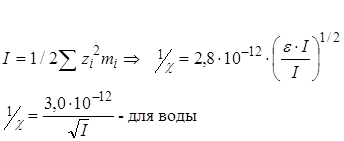
I – ввели Льюис и Ренделл для характеристики интенсивности электрического поля, возникающего из-за наличия ионов в растворе.
1/χ≥ε, T и 1/χ<I
Это теория, позволяющая рассчитать химический потенциал, γ и некоторые кинетические свойства.
Концентрационные границы применимости: I≤0,01
Для электролита типа 1-1:
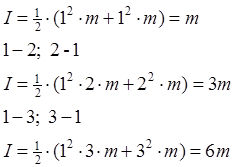
Дебая-Хюккеля.
Из экспериментов следует, что
электролиты имеют одинаковый коэффициент активности при одинаковой ионной силе.
γ± имеет линейную зависимость от ионной силы: ![]() , до I<0,01,
затем наблюдается отклонение. У электролитов с большим зарядом и при меньших
температурах и меньшей диэлектрической проницаемости среды.
, до I<0,01,
затем наблюдается отклонение. У электролитов с большим зарядом и при меньших
температурах и меньшей диэлектрической проницаемости среды.
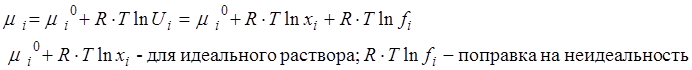

Если раствор сильного электролита
достаточно (предельно) разбавлен, то расстояние между ионами будет велико, а
энергией взаимодействия между ионами можно пренебречь. Такой раствор называют
идеальным. Отклонение от идеальности обусловлено наличием зарядов на ионах. ![]() идёт на преодоление электростатических
взаимодействий иона и ионной атмосферы
идёт на преодоление электростатических
взаимодействий иона и ионной атмосферы
 |
.
Этот закон может быть использован в таком виде:
для электролитов 1-1 c≤0,05 моль/л;
для 1-2; 2-1 c≤0,005 моль/л;
Если ввести параметр наибольшего сближения ионов, тогда:
 |
c·I – вводится для учёта поляризации дипольных молекул растворителя вокруг
иона растворённого вещества и для учёта гидратных оболочек.
c – const (здесь это не концентрация) определяется опытно, в таком виде формула работает до концентраций 1-2 моль/л.
![]()


![]()
![]() Вывод: теория Дебая-Хюккеля, основанная на представлении о объёмной атмосфере
позволяет правильно рассчитать константы активности
Вывод: теория Дебая-Хюккеля, основанная на представлении о объёмной атмосфере
позволяет правильно рассчитать константы активности ![]() при
небольших концентрациях.
при
небольших концентрациях.
![]()
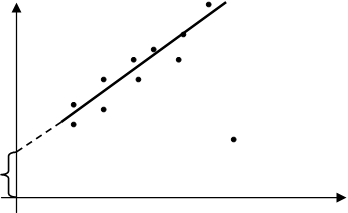
3-е приближение
2-е приближение
1-е приближение
![]()
![]() CH3COOH
CH3COO- + H+
CH3COOH
CH3COO- + H+
(1-α)·с α·c α·c
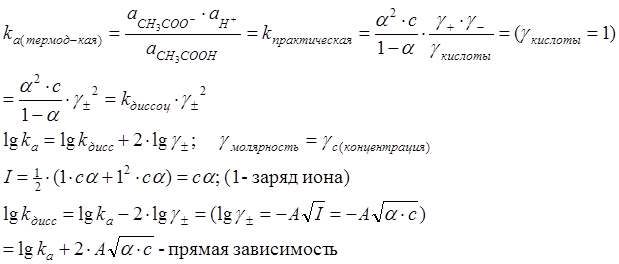 |
|||
 |
|||
lg ka
Электрическая проводимость растворов электролитов. Удельная, молярная и эквивалентная проводимость.
Электрическая проводимость – величина, обратная сопротивлению [Ом-1];
[Сименс]=[См].
Растворы электролитов – проводники второго рода, т.к. они проводят электрический ток за счёт заряженный частиц – ионов (проводники первого рода – металлы, они проводят электрический ток за счёт заряженных частиц – свободных электронов (электронный газ)).
Проводники первого рода - более эффективные.
Удельная электрическая проводимость - ![]() для проводников второго рода это
проводимость такого объёма электролита, в котором содержится
для проводников второго рода это
проводимость такого объёма электролита, в котором содержится
1 моль растворённого вещества, помещённого между плоскопараллельными электродами, на расстоянии 1 метр (1 см), с площадью s=10-3/ c, либо 103/c.
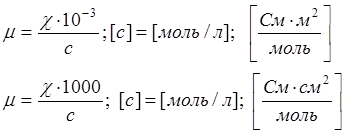 |
Чтобы привести сравниваемые электролиты к единичному заряду используют эквивалентную проводимость.
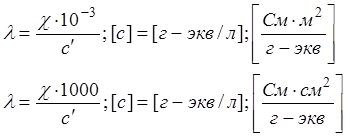
Эквивалентная проводимость – это проводимость такого объёма электролита, в котором содержится один грамм-эквивалент растворённого вещества, помещённый между плоскопараллельными электродами на расстоянии 1 м (1 см), площадью s=10-3/ c, либо 103/c.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.