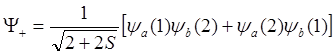 ;
(6.18)
;
(6.18)
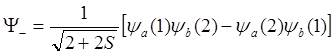 .
(6.19)
.
(6.19)
Здесь ya(1) =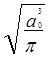
![]() ; yb(2) =
; yb(2) = 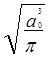
![]() . (6.20)
. (6.20)
Рассматривая
интеграл С (6.11) можно видеть, что он представляет собой
взаимодействие зарядовых облаков электронов между собой и с ядрами соседнего
атома, а также взаимодействие между ядрами. При этом плотность заряда электрона
у ядра “а” ![]() , а у ядра “b”
, а у ядра “b”![]() . Исходя из классических позиций
именно интеграл С должен определять взаимодействие двух атомов
водорода. Однако главную роль в образовании молекулы водорода играет интегралА, а не С.
Интеграл А отражает тот факт, что оба электрона неразличимы.
. Исходя из классических позиций
именно интеграл С должен определять взаимодействие двух атомов
водорода. Однако главную роль в образовании молекулы водорода играет интегралА, а не С.
Интеграл А отражает тот факт, что оба электрона неразличимы.
Для того, чтобы оценить силы притяжения (или отталкивания) необходимо знать величины и знаки интегралов А, С и S2. Очевидно, что интеграл S2 играет незначительную роль. В С и А присутствуют члены с противоположными знаками и их результирующий знак зависит от того, что больше: отталкивание двух электронных облаков и двух ядер друг от друга или притяжение электронных облаков к ядрам противоположных атомов. Рассмотрим несколько случаев. При очень больших расстояниях между атомами обменная зарядовая плотность r = 0, т.к. при этом ya и yb практически не перекрываются. Соответственно интегралы С и А исчезают. В случае средних расстояний » 2/a электронные зарядовые облака заметно перекрываются. На расстоянии » 1/a от ядра плотность заряда имеет наибольшее значение. Кроме того, на этом расстоянии наибольшая и обменная плотность заряда. Вследствие этого в интеграле А большее значение имеют отрицательные слагаемые.
При оценке величины интеграла С следует обратить внимание на то, что расстояния электронных облаков от соседних ядер превышают расстояние обменной электронной плотности от ядер. Поэтому интеграл С по модулю заметно меньше интеграла А. Следовательно знак величины Е(R) определяется знаком интеграла А и будет отрицательным для случая синглета (симметричной орбитальной ВФ отвечает антисимметричная спиновая ВФ):
DЕ+(R) = 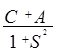 ;
(6.21)
;
(6.21)
и положительным для случая триплета:
DЕ-(R) = 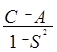 .
(6.22)
.
(6.22)
Т.о. величина DЕ+(R) отвечает за притяжение атомов водорода, а DЕ-(R) за их отталкивание. При очень малых расстояниях между атомами водорода возникает сильное отталкивание между ядрами (очень велика энергия отталкивания е2/R). Вследствие этого значения интегралов С и А становятся положительными и очень большими. На рис. 6.2 представлена зависимость энергии взаимодействия DЕ(R) от расстояния между ядрами.
Следует отметить, что независимо от расстояния между двумя атомами водорода в случае параллельности спинов их электронов (триплетное состояние) имеет место только отталкивание, которое возрастает при сближении атомов. Вся кривая DЕ-(R) находится в положительной области значений энергии и, следовательно, молекула водорода в таком состоянии существовать не может. Для антипараллельных спинов (синглет) энергия взаимодействия имеет минимум в отрицательной области значений энергии
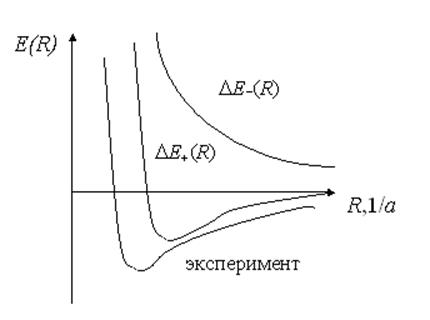
Рис.6.2. Зависимость энергии взаимодействия между атомами водорода от расстояния
на расстоянии близком к боровскому радиусу. При небольших расстояниях и в этом случае возникает отталкивание, т.е. энергия становится положительной. DЕ+(R) имеет область отрицательных значений с минимумом при R = 1.6/a. В этом случае образуется устойчивая комбинация атомов водорода, т.е. молекула водорода. Главная причина образования устойчивой молекулы – квантово-механический эффект электронного обмена и основная часть энергии связи молекулы связана с интегралом А.
Таблица 6.1. Расчётные и экспериментальные данные для молекулы водорода.
|
Определяемый параметр |
Эксперимент |
Расчёт |
|
Энергия диссоциации, эВ |
4,75 |
3,14 |
|
Равновесное расстояние, 1/a |
1,4 |
1,6 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.