Приложение 1
Реакция в открытой системе при постоянном давлении.
Будем использовать следующие обозначения:
|
Сим-вол |
Величина |
Связь с другими величинами |
Размер-ность |
Vр |
Объём реактора |
л |
|
|
C0А, CА |
Концентрация реагента на входе и выходе реактора |
|
моль/л |
|
ni |
Стехиометрический коэффициент |
Знак: для реагента (–), для продукта (+) |
|
W |
Скорость реакции |
|
(моль/л)×с-1 |
|
u0 и u |
Объёмная скорость на входе и выходе реактора |
л/с |
|
|
n |
Число молей |
моль |
|
|
|
Потоки реагента А на входе и выходе реактора |
|
моль/с |
|
x |
Степень превращения реагента А |
|
Безразмер-ная величина |
|
|
Время контакта |
|
c |
I. Реактор полного смешения.
Рассмотрим несколько примеров, начиная с наиболее простых.
Пример 1. Реакция первого порядка без изменения общего числа частиц А ¾® В.
Для реакции в закрытой системе кинетическое уравнение имеет вид
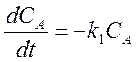 .
.
Если реакция протекает в открытой системе в проточном реакторе полного смешения, то в уравнение необходимо добавить члены, описывающие изменение концентрации вещества за счёт его втекания и вытекания.
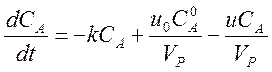 .
.
Поскольку для реакции без изменения числа частиц u = u0, в стационарном состоянии получаем соотношение
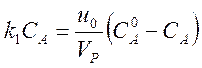 ,
,
из которого
легко найти стационарную концентрацию СА. В данном примере
при протекании реакции не происходит изменения объёма. Поэтому степень
превращения х может быть найдена, как ![]() .
.
Пример 2.
Реакция второго порядка без изменения числа частиц 2А ¾® C + D.
В стационарном состоянии те же соображения приводят к уравнению
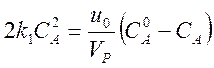 .
.
Пример 3. Реакция c изменением числа частиц.
Рассмотрим общий случай, когда реакция произвольного порядка, в которой
одним из реагентов является вещество А, протекает в реакторе полного
смешения и число частиц не остаётся постоянным. При этом u¹u0 и ![]() , поскольку концентрация реагента
изменяется не только из-за его расходования, но и из-за разбавления продуктами
реакции. Оказывается, что в этих условиях более простые соотношения получаются
не для концентраций, а для потоков частиц на входе и выходе химического
реактора.
, поскольку концентрация реагента
изменяется не только из-за его расходования, но и из-за разбавления продуктами
реакции. Оказывается, что в этих условиях более простые соотношения получаются
не для концентраций, а для потоков частиц на входе и выходе химического
реактора.
В закрытой системе скорость любой химической реакции, по определению равна
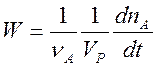 . (1)
. (1)
Отсюда
![]()
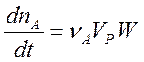 . (2)
. (2)
Для реакции в открытой системе в реакторе полного смешения
![]()
![]() [моль/с]
[моль/с]
![]()
![]() [л/с]
[л/с]
уравнение (2) необходимо дополнить членами, описывающими изменение количества вещества А в реакторе за счёт его втекания и вытекания.
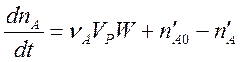 .
.
В стационарном случае
![]() .
.
Это уравнение имеет ясный смысл: разность потоков реагента А на входе и выходе реактора равна скорости его химического превращения во всём объёме реактора.
Вводя степень превращения
вещества А, как ![]() , получаем
, получаем
![]() .
.
Поскольку ![]() , а
, а ![]() , последнее равенство можно записать также
в виде
, последнее равенство можно записать также
в виде
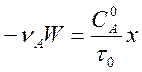 , (3)
, (3)
где ![]() –
время контакта, а
–
время контакта, а ![]() есть функция степени
превращения. Это соотношение справедливо в общем случае. В некоторых случаях
нам будет удобно представлять его в виде
есть функция степени
превращения. Это соотношение справедливо в общем случае. В некоторых случаях
нам будет удобно представлять его в виде
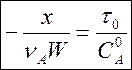 (3а)
(3а)
Пример 4. Реакция первого порядка, протекающая с увеличением числа частиц А ¾® В + С.
Подставляя в равенство (3) nА = –1 имеем
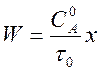 . (4)
. (4)
Теперь нужно выразить скорость реакции W через степень превращения, используя закон действующих масс.
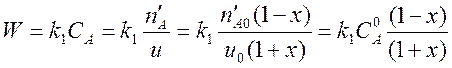 . (5)
. (5)
Подставляя выражение (5) в уравнение (4), получаем квадратное уравнение для вычисления х.
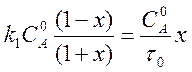 .
.
Его решение не вызывает затруднения.
При выводе
этого уравнения мы учли, что ![]() и
и ![]() . Если первое из этих двух соотношений
является следствием определения степени превращения х, то второе требует
пояснения.
. Если первое из этих двух соотношений
является следствием определения степени превращения х, то второе требует
пояснения.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.