![]() (2.17.)
(2.17.)
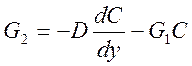 (2.18.)
(2.18.)
где G1 и G2 – соответственно удельная производительность по растворителю и растворённому веществу;
D – коэффициент диффузии растворённого вещества в растворе.
Введём понятие истинной селективности φи, т. е. селективности с учётом явления концентрационной поляризации:
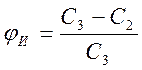 ,
где (2.19.)
,
где (2.19.)
С3 – концентрация растворённого вещества у поверхности мембраны.
При допущении постоянства потока растворённого вещества по всей длине пограничного слоя
![]() (2.20.)
(2.20.)
С учётом уравнения (2.18.) и (2.19.) получим:
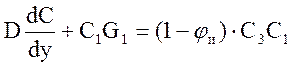 (2.21.)
(2.21.)
Граничными условиями являются:
при y = 0 C = C3
при y = ![]() C = C1
C = C1
где ![]() - толщина пограничного слоя.
- толщина пограничного слоя.
Интегрируя уравнение (2.21.), получим
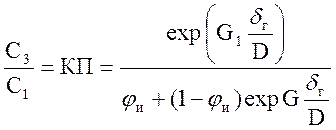 (2.22.)
(2.22.)
Отношение D/![]() представляет
собой не что иное, как коэффициент массоотдачи β растворённого вещества от
поверхности мембраны в объём раствора. Введя β в уравнение (2.22.), получим
представляет
собой не что иное, как коэффициент массоотдачи β растворённого вещества от
поверхности мембраны в объём раствора. Введя β в уравнение (2.22.), получим
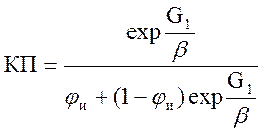 (2.23.)
(2.23.)
В случае φи = 1 предыдущее уравнение упрощается и принимает вид:
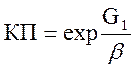 (2.24.)
(2.24.)
2.8. Методы экспериментального определения КП.
Использование для определения величины концентрационной поляризации микроэлектродов. Этот метод основан на применении микроэлектродов для измерения концентрационной поляризации. К недостаткам метода относятся влияние самих микроэлектродов на поток (поляризационный слой), сложность их изготовления и необходимость экранирования металлических частей.
Указанных недостатков лишены оптические методы определения КП. Они позволяют изучать поляризационный слой, не нарушая его структуры. Однако интерферометрический и теневой методы с применением оптических квантовых генераторов в случае сравнительно высокой концентрации разделяемого раствора (>0,2 моль/л) не позволяют исследовать распределение концентраций в слое КП вследствие искривления светового пучка при прохождении через раствор.
Электродиффузионный метод. Сущность его заключается в следующем. При установившемся режиме течения раствора электролита скорость электрохимической реакции определяется скоростью разряда ионов на поверхности электрода, которая может быть выражена дифференциальным уравнением:
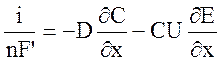 , где (2.25.)
, где (2.25.)
i – плотность тока; n – заряд реагирующих ионов;
F’ – число Фарадея;
D – коэффициент диффузии ионов в растворе;
С - -текущая концентрация иона;
х – координата по нормали к поверхности мембраны;
Е – потенциал;
U - подвижность ионов.
Уравнение, применяемое на практике имеет, вид:
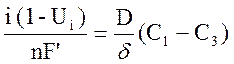 , где (2.26.)
, где (2.26.)
δ – толщина погранслоя.
Концентрация ионов вблизи электрода зависит то потенциала электрода и при увеличении приложенной разности потенциалов стремится к нулю. При этом плотность тока достигает максимального значения, так называемого предельного iпр
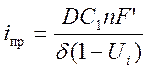 (2.27.)
(2.27.)
Уравнение можно преобразовать следующим образом:
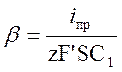 (2.28.)
(2.28.)
где z – число принимаемых ионом электронов;
S – поверхность электрода.
Косвенные методы. Один из таких методов основан на использовании истиной селективности мембраны. При этом учитывают зависимость, связывающую концентрацию растворённого вещества у поверхности мембраны с удельной производительностью и коэффициентом массоотдачи:
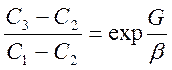 (2.29.)
(2.29.)
С учётом уравнений (2.25.) и (2.26.) получим
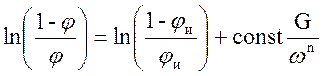 (2.30.)
(2.30.)
Это выражение является уравнением прямой линии в полулогарифмических координатах:
![]() (2.31.)
(2.31.)
где y = (1- φ)/φ; X = G/ωⁿ; B = (1- φи) / φи
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.