Теоретическое объяснение спектральных закономерностей атома водорода впервые дано в полуклассической теории Бора (см. приложение к настоящей работе стр.).
После открытия волновых свойств вещества стало ясно, что теория Бора является переходным этапом на пути к созданию последовательной теории атомных явлений. Такой теорией явилась квантовая механика.
В квантовой механике
состояние электрона в атоме водорода определяется заданием полной энергии
электрона Е, величиной момента количества движения М, ориентацией
этого момента на некоторое направление в пространстве ![]() .
.
Состояние электрона
можно также задать с помощью набора квантовых чисел ![]() ,
которые и определяют значения Е, М и МZ.
,
которые и определяют значения Е, М и МZ.
Параметр п, называется главным квантовым числом, определяет собственные (дозволенные) значения электрона в атоме водорода. Согласно законам квантовой механики, электрон может находиться в ряде устойчивых (стационарных) состояний, характеризуемых набором дискретных значений полной энергии Еп:
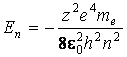 , (1.5)
, (1.5)
где ![]() –
порядковый номер элемента в таблице Менделеева. Для водорода
–
порядковый номер элемента в таблице Менделеева. Для водорода ![]() =1;
=1;
е – заряд электрона, е = 1,6×10-19 Кл;
![]() –
электрическая постоянная,
–
электрическая постоянная, ![]() =8,85×10-12 Ф×м-1;
=8,85×10-12 Ф×м-1;
![]() –
постоянная Планка,
–
постоянная Планка, ![]() =6,62×10-34 Дж×с;
=6,62×10-34 Дж×с;
те – масса электрона, те = 9,1×10-31 кг.
Главное квантовое число принимает значения п = 1, 2, 3, … .
Полная энергия электрона Еп отрицательна, это означает, что атом – устойчивая система, для разрушения которой необходимо затратить энергию (энергия ионизации атома водорода 13,6 эВ).
При переходе из одного
стационарного состояния в другое атомы испускают или поглощают излучение в виде
кванта энергии ![]() , равного разности энергий
тех стационарных состояний, между которыми совершается квантовый переход:
, равного разности энергий
тех стационарных состояний, между которыми совершается квантовый переход:
![]() , (1.6)
, (1.6)
где ![]() ;
;
![]() –
энергия состояния, из которого совершается переход;
–
энергия состояния, из которого совершается переход;
![]() –
энергия состояния, в которое атом переходит.
–
энергия состояния, в которое атом переходит.
Если для определения энергии ![]() и
и ![]() использовать
формулу (1.5), то для атома водорода:
использовать
формулу (1.5), то для атома водорода:
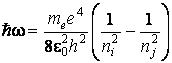 ,
,
откуда
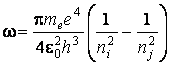 , (1.7)
, (1.7)
 . (1.8)
. (1.8)
Сравнивая формулы, полученные квантовой механикой (1.7), (1.8) с экспериментально найденными закономерностями (1.1) и (1.4) соответственно, можно определить теоретическое значение постоянной Ридберга:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.