![]() .
.
В полученное уравнение входят все три параметра: р, V и Т. Один из них можно исключить с помощью уравнения состояния. Чтобы получить уравнение политропы сразу в переменных р и V, исключим Т. Для этого продифференцируем уравнение Менделеева -Клапейрона pV = RT:
![]() .
.
Тогда ![]() или
или ![]()
 Согласно уравнению Майера
Согласно уравнению Майера ![]() , тогда, разделив переменные,
получаем
, тогда, разделив переменные,
получаем
![]()
Величины ![]() являются постоянными. Поэтому после
интегрирования получаем
являются постоянными. Поэтому после
интегрирования получаем
![]()
Разделив это соотношение на ![]() (что возможно, если с
(что возможно, если с![]() сv) и произведя потенцирование,
получим
сv) и произведя потенцирование,
получим
![]() (5.10)
(5.10)
где ![]() (4.11)
(4.11)
Это и есть искомое
уравнение политропы идеального газа для случая, когда с![]() сv. Величина п
называется показателем политропы.
сv. Величина п
называется показателем политропы.
Чтобы установить характер политропического процесса при с = сv, обратимся к уравнению (5.10). При с = сv это уравнение принимает вид (с − сp) ln V = const, откуда следует, что V в ходе процесса остается постоянным. Таким образом, политропический процесс с теплоемкостью с = сv является изохорическим процессом. Это можно было предвидеть заранее, поскольку сv = const и представляет собой теплоемкость при постоянном объеме, т. е. при изохорическом процессе. Согласно (5.11) показатель политропы при изохорическом процессе равен бесконечности.
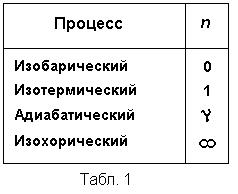
Остальные рассмотренные в предыдущем параграфе процессы также относятся к категории политропических процессов. Изобарическому процессу соответствует n = 0, изотермическому — n = 1 и, наконец, адиабатическому — n = γ. Значения показателя политропы n для перечисленных процессов даны в табл1.
Решив уравнение (5.11) относительно с, получим
формулу для теплоемкости идеального газа при политропическом процессе:![]()
![]() .
.
Подстановка n = γ обращает это выражение в нуль
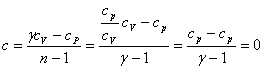 .
.
Следовательно, теплоемкость идеального газа при адиабатическом процессе равна нулю. При адиабатическом процессе теплоемкость равна нулю для всех тел. Это вытекает из того, что при адиабатическом процессе d'Q = 0, в то время как изменение температуры dT отлично от нуля.
При n = 1
![]()
Таким образом, при изотермическом процессе теплоемкость бесконечно велика. Это объясняется тем, что при изотермическом процессе dT = 0, в то время как теплота d'Q отлична от нуля.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.