|
Концентрация, моль/л |
|
|
||
|
|
|
|
|
|
|
0,0003 0,0005 0,001 0,002 0,1 |
0,975 - 0,965 0,952 0,906 |
0,971 - 0,954 0,946 0,840 |
- 0,780 0,700 0,608 0,387 |
- 0,863 0,812 0,745 0,517 |
Опытные и вычисленные значения наклона прямых lg f± — (J)1/2, относящиеся к разбавленным растворам электролитов в смесях воды и этанола, приведены в табл. 9.
ТАБЛИЦА 9
Опытные и
вычисленные наклоны прямых ![]() для различных типов
электролитов. (Растворитель – смесь воды и этилового спирта, t=25°C)
для различных типов
электролитов. (Растворитель – смесь воды и этилового спирта, t=25°C)
|
D растворителя |
1-1 |
1-2 |
3-1 |
|||
|
Опыт. |
Вычисл. |
Опыт. |
Вычисл. |
Опыт. |
Вычисл. |
|
|
78,8 54,0 41,0 33,8 |
0,50 0,89 1,31 1,90 |
0,50 0,89 1,32 1,80 |
1,40 1,74 2,74 - |
1,08 1,76 2,65 - |
1,52 4,00 6,10 - |
1,51 2,65 3,98 - |
И здесь расхождение между теорией и опытом увеличивается с ростом сил взаимодействия между ионами, т. е. при увеличении валентности ионов и уменьшении диэлектрической постоянной растворителя. Эти и другие опытные данные указывают на то, что теория Дебая и Гюккеля правильно описывает поведение электролитов в той области, в которой сохраняют силу сделанные допущения.
Дальнейшее развитие теории Дебая и Гюккеля. Первая попытка усовершенствовать теорию Дебая и Гюккеля и расширить область ее применения была сделана самими авторами. В так называемом втором приближении они отказались от представления об ионах как о материальных точках (допущение 3) и попытались учесть конечные размеры ионов, наделив каждый электролит некоторым средним диаметром а (следует отметить, что при этом изменяется одновременно и допущение 4). Приписав ионам определенные размеры, Дебай и Гюккель учли тем самым существование отталкивательных сил некулоновского происхождения, препятствующи сближению ионов противоположного заряда на расстояние, меньшее некоторой величины, обусловливаемой природой электролита. Во втором приближении коэффициент активности i-го сорта ионов после таких же преобразований, какие были сделаны при выводе предельного закона (при проведении расчетов принимается, что расстояние а отвечает минимальной потенциальной энергии), описывается уравнением
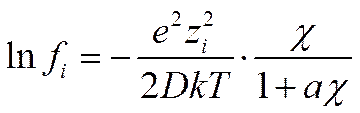 (I I-62)
(I I-62)
или
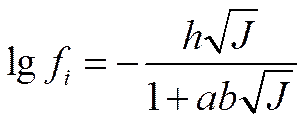 (I I-63)
(I I-63)
где b=χ/(J)1/2; a hсохраняет прежнее значение. Для среднего коэффициента активности электролита, распадающегося на v ионов, из которых ν+ имеют валентность z+, a ν- — валентность z-, второе приближение теории Дебая — Гюккеля приводит к уравнению
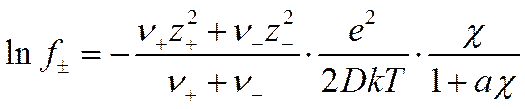 (I I-64)
(I I-64)
Все уравнения второго приближения отличаются от соответствующих уравнений первого приближения на множитель
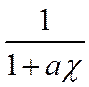
Величина а по ее физическому смыслу зависит не только от природы того электролита, средний коэффициент активности которого вычисляется, но и от природы других электролитов, присутствующих в растворе, поскольку все ионы раствора участвуют в формировании ионной атмосферы. В связи с этим кристаллохимические радиусы индивидуальных веществ не могут быть использованы для определения среднего ионного диаметра электролита а, и его находят опытным путем. Следовательно, уравнения второго приближения в отличие от первого содержат эмпирическую константу.
Лучшее
согласие с опытом удалось получить Ла Меру и его сотрудникам. Сохраняя
допущения, сделанные Дебаем и Гюккелем в их втором приближении, они дали более
точное математическое решение основного дифференциального уравнения. Ими было
показано, что если учитывать не два, а большее число членов разложения в ряд
показательной функции 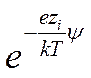 , то уравнение для среднего
коэффициента активности бинарного электролита примет вид
, то уравнение для среднего
коэффициента активности бинарного электролита примет вид
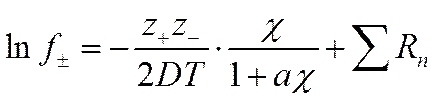 (I I-65)
(I I-65)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.