Модель раствора электролита по Дебаю и Гюккелю. Современная теория растворов электролитов, основные положения которой были сформулированы в 1923 г. Дебаем и Гюккелем, возникла как попытка усовершенствовать теорию Гхоша. Дебай и Гюккель попытались создать представление о растворах, в котором нашли бы отражение и межионное взаимодействие, и эффект теплового движения. Дебай и Гюккель принимают основную идею Гхоша о том, что в растворе сохраняется присущее кристаллам распределение ионов, при котором каждый из них окружен преимущественно ионами противоположного знака. Однако в растворах, в отличие от кристаллов, тепловое движение ионов приводит к тому, что они не сохраняют своего фиксированного положения в узлах кристаллической решетки, а располагаются вокруг выбранного центрального иона в виде сферы. Исходя из того, что в растворе основным видом движения является поступательное (а не колебательное, как в кристаллах), одни и те же ионы не могут постоянно входить в состав сферы, окружающей центральный ион. Они непрерывно обмениваются своими местами с другими ионами. Такая статистическая сфера, окружающая центральный ион, называется ионной атмосферой. Все ионы раствора равноправны, каждый из них окружен ионной атмосферой и в то же время каждый центральный ион входит в состав ионной атмосферы какого-либо другого иона (рис. 5). Существование ионных атмосфер и есть тот характерный признак, который по Дебаю и Гюккелю отличает реальные растворы электролитов от идеальных. Дополнительная энергия G* реальных растворов
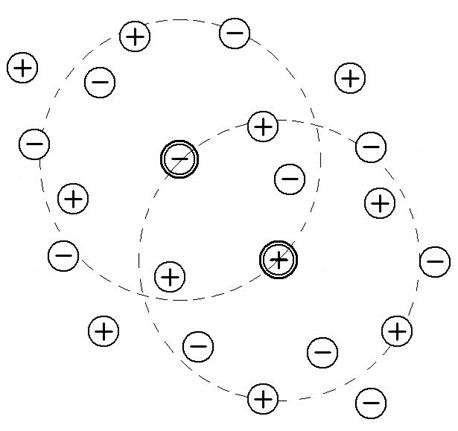
Рис.5. Модель ионной атмосферы, принятая теорией Дебая и Гюккеля.
должна поэтому отражать эффект суммарного действия ионных атмосфер на центральные ионы. Вычисление коэффициентов активности сводится к тому, чтобы найти выражение этой энергии через свойства растворов, доступные прямому определению.
Расчет энергии межионного взаимодействия и коэффициентов активности.
Энергия, связанная с ионной атмосферой,— электрическая, поэтому она должна быть функцией плотности электрического заряда и потенциала, создаваемых ионной атмосферой. Так как последняя представляет собой статистическое образование, можно не учитывать дискретное распределение зарядов и использовать уравнение Пуассона для связи между средней плотностью заряда р и отвечающей ему средней величиной потенциала ψ
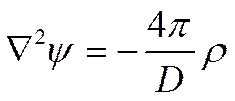 (I I-31)
(I I-31)
где D—диэлектрическая постоянная; а V2—оператор Лапласа, который можно выразить в прямоугольных координатах
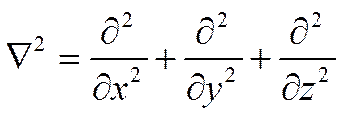 (I I - 32)
(I I - 32)
В уравнение Пуассона входят две неизвестные величины — ρ и ψ. Чтобы их найти, необходимо иметь второе уравнение, связывающее обе эти переменные. Дебай и Гюккель получили нужное уравнение следующим образом.
Пусть объем раствора равен V, полное число ионов первого сорта равно N1второго—N2, i-го—Niи последнего—Nh, а их заряды равны соответственно ez1 , ez2 , eziи ezk. Так как число зарядов положительных и отрицательных ионов электролита одинаково, то
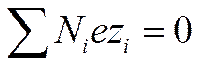 И
И 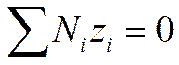 (I I - 33)
(I I - 33)
Закон электронейтральности справедлив не только для раствора в целом, но и для любого заданного элемента его объема, достаточно большого по сравнению с размерами иона. Если выбран объем раствора, равный единице, то
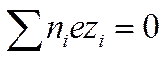 И
И 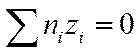 (I I -34)
(I I -34)
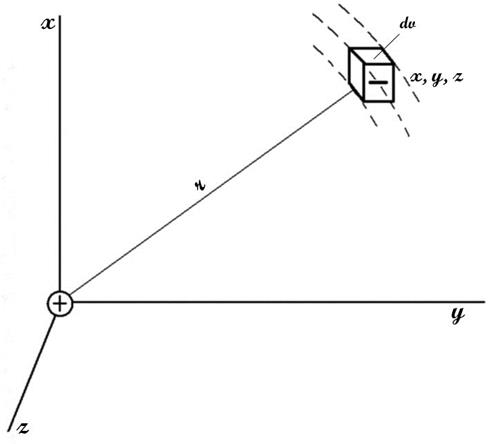
Рис.6. Схема распределения зарядов в поле центрального иона.
где n1—число ионов i-го сорта в единице объема (например, в 1 мл). Однако заряд некоторого элемента объема dV, находящегося вблизи какого-либо иона и перемещающегося вместе с ним во время теплового движения внутри раствора (рис. 6), будет отличаться от нуля вследствие существования ионной атмосферы. Если центральный ион, расположенный в начале координат, заряжен положительно, то элемент объема dVбудет обладать избыточным отрицательным зарядом. Предполагая, что к распределению ионов в растворе применим принцип Больцмана и что силы, действующие между ионами, по своей природе электростатические, число отрицательных ионов в элементарном объеме dVможно выразить как
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.